
| ||
| △ |
| △c |
| △t |
| bmol/L |
| tmin |
| b |
| t |
| b |
| t |


科目:高中化学 来源:不详 题型:单选题
| A.v(A)=0.3mol?L-1?min-1 | B.v(B)=0.6mol?L-1?min-1 |
| C.v(C)=0.5mol?L-1?min-1 | D.v(D)=0.01mol?L-1?S-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| A.增加C的用量 | B.选择合适的催化剂 |
| C.碾细固体反应物 | D.提高反应体系的温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
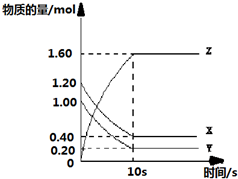
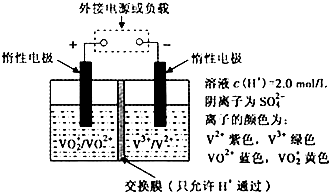
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.vA2=0.4mol/(L?min) | B.vB2=0.6mol/(L?min) |
| C.vAB3=0.5mol/(L?min) | D.vA2=0.3mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

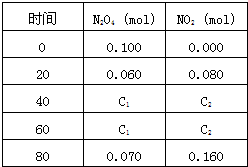
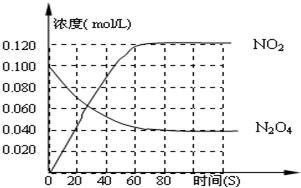
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.甲更快 | B.无法确定 | C.相等 | D.乙更快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| A.用A表示的反应速率是0.4mol/(L?min) |
| B.分别用B、C、D表示反应的速率,其比值是3:2:1 |
| C.在2min末的反应速率,用B表示是0.3mol/(L?min) |
| D.在这2min内B和C物质浓度都逐渐减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com