
| A. | 稀释浓硫酸时,将水沿器壁慢慢注入酸中 | |
| B. | 点燃氢气前,先检验氢气的纯度 | |
| C. | 加热液体时,试管口不对着人 | |
| D. | 利用丁达尔效应区别胶体和溶液 |
分析 A.稀释时将密度大的液体注入密度小的液体中;
B.不纯可燃性气体点燃易发生爆炸;
C.加热液体,防止液体飞溅,烫伤自己或别人;
D.丁达尔现象为胶体特有的性质.
解答 解:A.稀释时将密度大的液体注入密度小的液体中,则稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,故A错误;
B.不纯可燃性气体点燃易发生爆炸,则点燃氢气前,先检验氢气的纯度,故B正确;
C.加热液体,防止液体飞溅,烫伤自己或别人,则加热液体时,试管口不对着人,故C正确;
D.丁达尔现象为胶体特有的性质,则丁达尔效应可区别胶体和溶液,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作、实验安全、物质的鉴别、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 奎宁酸和莽草酸是某些高等植物特有的脂环状有机 酸常共存在一起,其结构简式如图所示.下列说法正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机 酸常共存在一起,其结构简式如图所示.下列说法正确的是( )| A. | 奎宁酸与莽草酸互为同分异构体 | |
| B. | 两种酸含有的官能团完全相同 | |
| C. | 两种酸均能发生加成反应、聚合反应和取代反应 | |
| D. | 等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入过量浓盐酸:H+、Ba2+、Cl-、ClO- | |
| B. | 加入过量NaHCO3稀溶液:Na+、HCO3-、CO32-、C1O- | |
| C. | 加入过量 Fe(NO3)2溶液:Ba2+、NO3-、Fe2+、C1O- | |
| D. | 加入过量 Na2SO4溶液:Ba+、ClO-、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
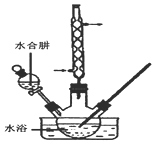 碘化钠是一种白色结晶粉末,医疗上可用于甲状腺肿瘤防治剂、祛痰剂等.实验室用NaOH、单质碘和水合肼为原料制得,部分装置如图所示.
碘化钠是一种白色结晶粉末,医疗上可用于甲状腺肿瘤防治剂、祛痰剂等.实验室用NaOH、单质碘和水合肼为原料制得,部分装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
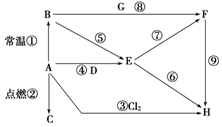 如图表示A~H八种物质的相互转化关系,其中A为金属单质,其余均为化合物,C为淡黄色粉末,D为常见的无色液体,G能使澄清石灰水变浑浊.
如图表示A~H八种物质的相互转化关系,其中A为金属单质,其余均为化合物,C为淡黄色粉末,D为常见的无色液体,G能使澄清石灰水变浑浊.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入H+能产生无色无味气体的溶液:OH-、K+、I-、SO32- | |
| B. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| C. | 0.1 mol•L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 在澄清透明的无色溶液中:Na+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L | B. | $\frac{100ρ}{103•65}$ mol/L | ||
| C. | $\frac{ρ}{103.65}$ mol/L | D. | $\frac{0.1ρ}{103•65}$ mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
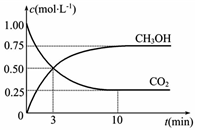 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com