
【题目】氧化还原反应在生产生活中有很多实际应用:
Ⅰ.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;②2SO2+SeO2+2H2O=Se+2SO![]() +4H+。
+4H+。
(1)Se与浓H2SO4的反应中,氧化剂是_______还原剂是________。
(2)依据反应①判断SeO2、浓H2SO4的氧化性强弱是:SeO2 ______ 浓H2SO4(填大于、小于或等于).
(3)用双线桥法标出反应②电子转移的方向和数目:_________________。
(4)SeO2、KI和HNO3发生如下反应,配平该反应的化学方程式____________。
SeO2+KI+HNO3→Se+I2+KNO3+H2O
Ⅱ.对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(5)含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO![]() ,同时生成NH3,该反应的离子方程式为_____________________________________________。
,同时生成NH3,该反应的离子方程式为_____________________________________________。
(6)硫酸铜溶液能与单质磷反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,被1mol CuSO4 氧化的P的物质的量__________。
【答案】浓硫酸或H2SO4 硒或Se 小于  SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O 2CN-+4H2O+O2
SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O 2CN-+4H2O+O2![]() 2HCO+2NH3 0.2mol
2HCO+2NH3 0.2mol
【解析】
(1)反应Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O中,Se的化合价升高被氧化,做还原剂;浓硫酸中硫元素化合价降低被还原,做氧化剂。
(2)在氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,因此依据反应①以及(1)中分析可知SeO2、浓H2SO4的氧化性强弱是SeO2小于浓H2SO4。
(3)反应②中,2molSO2共失去4mol电子,失去的电子被SeO2得到,从而被还原为Se,故此反应转移4mol电子,用双线桥法标出电子转移的方向和数目为 。
。
(4)在反应SeO2+KI+HNO3→Se+I2+KNO3+H2O中,SeO2得4个电子,而KI失1个电子,根据得失电子数守恒可知,SeO2的计量数为1,而KI的计量数为4,故Se的计量数为1,I2的计量数为2,根据质量守恒可知,KNO3的计量数为4,则HNO3的计量数为4,水的计量数为2,故方程式为SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O。
(5)含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,反应中N元素化合价从+2价升高到+4价,失去2个电子,1分子氧气得到4个电子,根据电子得失守恒、原子守恒以及电荷守恒可知该反应的离子方程式为2CN-+4H2O+O2![]() 2HCO+2NH3。
2HCO+2NH3。
(6)反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中铜元素化合价从+2价降低到+1价,得到1个电子,P元素化合价从0价升高到+5价,失去5个电子,则根据电子得失守恒可知被1molCuSO4氧化的P的物质的量是1mol÷5=0.2mol。


科目:高中化学 来源: 题型:
【题目】25 ℃时,不同酸性条件下的0.1 mol·L-1 HF溶液中,c(HF)、c(F-)与溶液pH的变化关系如图所示。下列说法正确的是
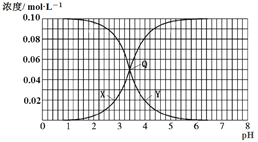
A. 随着溶液pH增大,![]() 不断增大
不断增大
B. 由水电离出的c(H+):Q>X=Y
C. HF的电离常数Ka=1.0×10-3.2
D. 0.1 mol/LNaF溶液的pH约为8.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是最理想的太阳能电池材料,高性能晶硅电池是建立在高质量晶硅材料基础上的。工业上可以用如图所示的流程制取高纯硅。
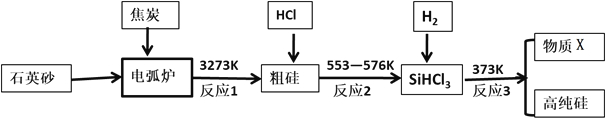
(1)硅在周期表中的位置是_______________,反应1中氧化剂与还原剂的物质的量之比为:__________________
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3 (沸点31.8℃)中含有少量SiCl4 (沸点57.6℃)和SiH2Cl2 (沸点8.2℃)、SiH3Cl(沸点-30.4℃)提纯SiHCl3采用的方法为__________,整个过程中可以循环利用的物质X是:_____________(填化学式)
(3)提纯粗硅的过程中必须严格控制无水无氧,原因之一是硅的卤化物极易水解,写出SiCl4遇水剧烈反应的化学方程式___________________________________
(4)硅在有HNO3存在的条件下,可以与HF生成H2SiF6,同时有不溶于水的气体生成,该气体遇空气变为红棕色,硅单质发生的化学方程式为_____________________________________________________
(5)某工厂用100吨纯度为75%的石英砂为原料经第一步反应制得的粗硅中含硅28吨,则该过程中硅的产率是:__________(精确到小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年12月,华为宣布: 利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是
C6+LiCoO2,其工作原理如图所示。下列关于该电池的说法不正确的是

A. 该电池若用隔膜可选用质子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 充电时,LiCoO2极 发生的电极反应为: LiCoO2-xe-=Li1-xCoO2+xLi+
D. 废旧的该电池进行“放电处理”让Li+从石墨烯中脱出而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种重要的化工原料,请回答下列问题:
I.高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠后,溶液紫红色逐渐褪去,并出现红褐色沉淀,请写出该反应的离子方程式__________。
II.实验室模拟下图所示流程制备亚硝酸钠:

已知:①氧化过程中,控制反应温度在35~60℃条件下主要发生反应:
C6H12O6+12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
②氢氧化钠溶液吸收NO和NO2发生反应:
NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O

(1)木屑的主要成分是纤维素,结合已知信息①,你认为向木屑中加稀硫酸的作用是______,氧化过程中反应温度不宜高于60℃,原因是______________。
(2)不做任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除了OH-外还有两种阴离子,其中一种是NO2-,NO2-与另一种阴离子的物质的量之比为________。
(3)装置B用于制备NaNO2,盛装的试剂除NaOH(aq)外,还可以是______(填字母)。
a.NaCl(aq) b.Na2CO3(aq) c.NaNO3(aq)
III.测定产品纯度:
【实验步骤】①准确称量ag产品配成200mL溶液;②从步骤①配制的溶液中移取20.00mL加入锥形瓶中;③用cmol/L酸性KMnO4溶液滴定至终点;④重复以上操作3次,消耗酸性KMnO4溶液的平均体积为VmL
(1)锥形瓶中发生反应的离子方程式为_____________。达到滴定终点的现象是_________。
(2)产品中NaNO2的纯度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化反应与还原反应在同一元素中进行的是( )
A. Cl2+2NaOH=NaCl+NaClO+H2O
B. Fe+CuSO4=FeSO4+Cu
C. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D. 2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述正确的是
A. 2.0gH218O与D216O的混合物中所含中子数为NA
B. 0.1molCl2溶于足量水中,转移的电子数为0.1NA
C. 常温常压下50g46%的乙醇溶液中,所含氧原子数目为0.5NA
D. 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com