
【题目】A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B的单质在D的单质中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A的单质在F的单质中燃烧伴有苍白色火焰,产物溶于水得到一种强酸。回答下列问题:
(1)F的元素符号为___________________________。
(2)A在周期表中的位置是 。
(3)A与D反应时,可以形成原电池,在原电池的负极上发生氧化反应的物质是________。
(4)B、D、E组成的一种盐中,E的质量分数为约43%,其俗名为 。
(5)E在D中燃烧产物的电子式为____________________________________。
(6)A与E可以形成离子化合物,该化合物与水反应的方程式为 。
【答案】(1)Cl (2)第一周期,ⅠA族 (3) H2 (4)苏打(纯碱)(5) ![]()
(6) NaH+H2O=NaOH+H2↑
【解析】
试题分析:A的单质在F的单质中燃烧伴有苍白色火焰,非金属元素A最外层电子数与其周期数相同,A是氢元素、F是氯元素;B的最外层电子数是其所在周期数的2倍, B是碳或硫、B的单质在D的单质中充分燃烧能生成其最高价化合物BD2 ,D能形成D2-,B为+4价,故B是碳、D是氧元素;E+与D2-具有相同的电子数,E是钠元素;(1)F的元素符号为Cl。
(2)H在周期表中的位置是第一周期,ⅠA族。
(3)氢氧燃料电池,负极发生氧化反应,在原电池的负极上发生氧化反应的物质是氢气。
(4)C、0、Na组成的一种盐中,E的质量分数为约43%,该盐是碳酸钠,其俗名为苏打。
(5)Na在O2中燃烧产物是过氧化钠,电子式为![]()
(6)H2与Na可以形成离子化合物NaH,该化合物与水反应的方程式为NaH+H2O=NaOH+H2↑。


科目:高中化学 来源: 题型:
【题目】纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂。目前主要的合成方法有电解法、高温固相法等。
(1)有研究表明阳极氧化法成功制得了Cu2O 纳米阵列,装置如图:
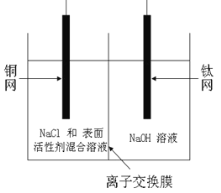
该电池的阳极反应方程式为 离子交换膜为_______(填阳或阴)离子交换膜,铜网应连接电源的_____极。
(2)在高温下用甲烷将粉状CuO 还原也可制得Cu2O。
已知:①2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H = -846.3 kJ/mol
③ Cu(s)+1/2O2(g)=CuO(s);△H = -157 kJ/mol
则该反应的热化学方程式是:__________。
(3)在相同的密闭容器中,用等质量的三种纳米Cu2O(用不同方法制得)分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+O2(g) △H>0。水蒸气浓度随时间t变化如下表所示:
2H2(g)+O2(g) △H>0。水蒸气浓度随时间t变化如下表所示:
序号 |
| 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
①对比实验的温度:T2 T1(填“﹥”“﹤”或“﹦”),原因是___________________。
②实验①前20 min的平均反应速率 v(O2)=
③比较不同方法制得的Cu2O的催化效果应选用__________组实验,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
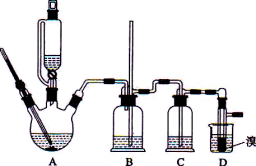
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式_____________________。
(2)装置B的作用是_____________________。
(3)在装置C中应加入___________(填字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用________(填字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚.可用_______________的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是_______________。
(7)判断该制备反应已经结束的最简单方法是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑩九种元素在周期表中的位置。

请回答:(以下用相应的元素符号回答问题)
(1)在表里填写①~⑩元素符号,写出元素符号①________、③________、⑧________。
(2)其中化学性质最不活泼的是________(填元素符号)。
(3)在②、③、④三种元素的氧化物对应的水化物中,碱性最强的是________(填化学式)。
(4)元素①、②、⑤按原子半径由大到小的顺序依次为________(填元素符号)
(5)元素⑥的氢化物的化学式是________,该氢化物溶于水,所得溶液的pH________(填“<”、“>”或“=”)7。
(6)元素②与元素⑧形成的化合物的电子式是________,高温下灼烧该化合物火焰呈________色。
(7)________(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验,完成下列各小题。

(1)碎瓷片的作用是_____________。
(2)B中现象是________,乙烯发生_______反应。
(3)C中现象是________,发生反应的化学方程式______________________。
(4)在D处点燃时必须进行的操作是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态铜原子的核外未成对电子数目为___________。
(2)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。

(3)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:
2NH3+3F2![]() NF3+3NH4F
NF3+3NH4F
上述化学方程式中的5种物质所属的晶体类型有___________。
(4)BF3与一定量水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

①晶体Q中各种微粒间的强相互作用力包括___________(填序号).
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为___________,阴离子的中心原子轨道采用1个2s原子轨道与___________个___________原子轨道杂化。
(5)将铜粉加入浓氨水中.再通入氧气,充分反应后溶液呈深盔色(一种铜离子的配位化合物).
该反应的离子方程式为___________。
(6)金属铁为体心立方晶胞结构(钾型).则晶体中的配位数为___________;若晶体的密度为ρg/cm3,铁原子半径为___________cm(用含ρ和NA的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A 0.2 mol 在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
(1)烃A的分子式为_____________。
(2)若取一定量的烃A完全燃烧后,生成CO2和H2O各3 mol,则有________g烃A参加了反应,燃烧时消耗标准状况下的氧气___________L。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为__________________。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分用元素符号或化学式回答下列问题。
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ① | ⑦ | ④ | ||||
3 | ③ | ⑤ | ⑧ | ⑩ | ||||
4 | ② | ⑨ |
(1)写出⑥与⑧元素组成的分子的电子式:_______。
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为 , 第三周期中除⑩元素以外离子半径最小的是 (填离子符号)。
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是 (填化学式),元素⑦的氢化物的结构式为 ; 该氢化物和元素④单质反应的化学方程式为 。
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为 。在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为 。
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式 ;④⑧⑨元素的离子的还原性由强到弱顺序为 (用离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气。
(1)已知:H2(g)+1/2O2(g)═H2O(g) △H1= —241.8 kJmol-1
2C(s)+O2(g)═2CO(g) △H2= —221 kJmol-1
由此可知焦炭与水蒸气反应的热化学方程式为
(2)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(3)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH,得到两组数据
CO2(g)+H2(g) ΔH,得到两组数据
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
该反应的![]() H 0(填“<”或“>”);若在9000C时,另做一组实验,在2L的恒容密闭容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时正 逆(填“<”,“>”,“=”)。
H 0(填“<”或“>”);若在9000C时,另做一组实验,在2L的恒容密闭容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时正 逆(填“<”,“>”,“=”)。
(4)一定条件下,某密闭容器中已建立A(g)+B(g)![]()
C(g)+D(g) △H>0的化学平衡,时间速率图像如右图,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是

A.减小压强,同时升高温度,平衡正向移动
B.增加B(g)浓度,同时降低C(g)浓度,平衡不移动
C.增加A(g)浓度,同时降低温度,平衡不移动
D.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H1<0
2N2(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g) +2NO2(g)![]() N2(g) +CO2(g) +2H2O(g) △H2<0
N2(g) +CO2(g) +2H2O(g) △H2<0
(5)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO)︰V (NO2)= 。
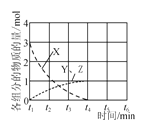
(6)在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示。写出Y和Z的化学式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com