
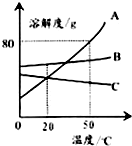
| A. | 50℃时A物质的溶解度最大 | |
| B. | 升温可使C物质的不饱和溶液变成饱和溶液 | |
| C. | 50℃时把90gA物质放入100g水中能得到190g溶液 | |
| D. | 将50℃三种物质的饱和溶液分别降温到20℃时,B溶液溶质质量分数最大 |
分析 A、根据溶解度曲线可比较同一温度时不同物质的溶解度;
B、C的溶解度随温度的升高而减小,所以升温可使C的不饱和溶液变饱和;
C、根据该温度下A的溶解度分析判断;
D、根据饱和溶液中溶质的质量分数计算方法及三种物质的溶解度随温度变化分析解答.
解答 解:A、由图可知:50℃时A的溶解度最大,故A正确;
B、C的溶解度随温度的升高而减小,所以升温可使C的不饱和溶液变饱和,故B正确;
C、50℃时A的溶解度是80g,所以把90gA物质放入100g水中最多溶解80g,能得到180g溶液,故C错误;
D、AB的溶解度随温度的降低而减小,C的溶解度随温度的降低而增大,饱和溶液中溶质质量分数的计算式$\frac{溶解度}{100+溶解度}$×100%,所以溶解度大则溶质质量分数大,则将50℃三种物质的饱和溶液分别降温到20℃时,AB析出晶体,C的溶解度增大,变为不饱和溶液,溶质的质量分数与降温前相等,此时B的溶解度大于A的溶解度大于降温前C的溶解度,故B溶液溶质质量分数最大,故D正确;
故选C.
点评 本题主要考查了学生对于溶解度曲线、饱和溶液、溶质的质量分数等知识的掌握和运用,能较好培养学生分析、解决问题的能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
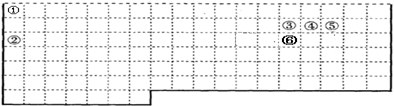
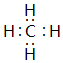 ,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物的化学式是SiO2.
,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物的化学式是SiO2. 、
、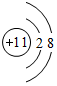 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
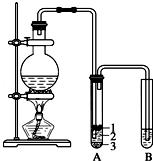 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 熵值增大的反应都能自发进行 | |
| C. | 由能量判据和熵判据组合而成的复合判据,适合于所有的反应 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | |
| B. | 存在Fe2+的溶液中:Mg2+、SO42-、ClO-、Na+ | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 高锰酸钾溶液:H+、Na+、SO42-、葡萄糖分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电子流向 |
| ① | Mg-Al | HNO3(浓) | Mg→Al |
| ② | Mg-Al | HCl(aq) | Mg→Al |
| ③ | Mg-Al | NaOH(aq) | Al→Mg |
| ④ | Al-Cu | HNO3(浓) | Cu→Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 4 | ⑪ | ⑫ |
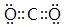 ;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程
;元素⑥可形成一种碱性氧化物,用电子式表示该碱性氧化物的形成过程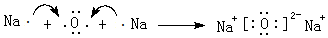 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com