
【题目】(15分)
重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3 , 还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:
FeO·Cr2O3+Na2CO3+NaNO3 ![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为。该步骤不能使用陶瓷容器,原因是。
(2)滤渣1中含量最多的金属元素是 , 滤渣2的主要成分是及含硅杂质。
(3)步骤④调滤液2的pH使之变(填“大”或“小”),原因是(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到(填标号)得到的K2Cr2O7固体产品最多。
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7 , 最终得到产品 m2 kg,产率为。
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是( )
A.任何物质中都含有化学键B.共价化合物中可能含有离子键
C.离子化合物中只含离子键D.离子化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是生产农药克百威的主要中间体.其合成路线如下: 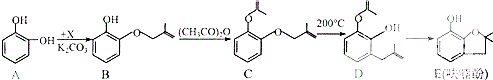
(1)A物质核磁共振氢谱中各组吸收峰的峰面积之比为 , B→C的反应类型是 , E中含氧官能团的名称是 , 1molD最多可以消耗molNaOH.
(2)已知X的分子式为C4H7Cl,写出A→B的化学方程式: .
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y发生消去反应所得产物的名称(系统命名)是 .
(4)下列有关化合物C、D的说法正确的是 . ①可用氯化铁溶液鉴别C和D
②C和D含有的官能团完全相同
③C和D互为同分异构体
④C和D均能使溴水褪色
(5)E有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式 . ①属于芳香族化合物
②苯环上的一氯代物只有一种
③含有酯基
④能发生银镜反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() U是重要的核工业原料,在自然界的存在很少.的浓缩一直为国际社会关注.下列有关
U是重要的核工业原料,在自然界的存在很少.的浓缩一直为国际社会关注.下列有关 ![]() U说法正确的是( )
U说法正确的是( )
A.![]() U原子核中含有92个中子
U原子核中含有92个中子
B.![]() U原子核外有143个电子
U原子核外有143个电子
C.![]() U与
U与 ![]() U互为同位素
U互为同位素
D.![]() U与
U与 ![]() U互为同素异形体
U互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础](15分) 氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
回答下列问题:
(1)A的结构简式为。C的化学名称是。
(2)③的反应试剂和反应条件分别是 , 该反应的类型是。
(3)⑤的反应方程式为。吡啶是一种有机碱,其作用是。
(4)G的分子式为。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有种。
(6)4-甲氧基乙酰苯胺( ![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚( ![]() )制备4-甲氧基乙酰苯胺的合成路线(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y元素最高正价与负价的绝对值之差是4,Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )
A. K2SB. Na2SC. Na2OD. KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氮及其化合物说法正确的是
A. 实验室利用铁片与稀硫酸或稀硝酸反应制取H2
B. 氨易液化,可用来做制冷剂
C. 用向上排空气法收集铜粉与稀硝酸反应产生的NO
D. 常温下,N2既能与O2反应,又能与H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下: ①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3-242kJ·mol-1
O2(g)= H2O(g) ΔH3-242kJ·mol-1
反应①的ΔH1为 kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是、;590℃之后,丁烯产率快速降低的主要原因可能是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com