
(3分)现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量(mol)的关系如图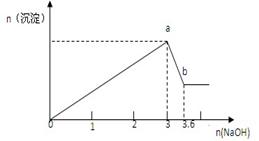
计算
(1)a处沉淀的总物质的量 mol
(2)c(FeCl3)= mol/L
(3)c(AlCl3)= mol/L
(1)1 (1分) (2) 4 (1分)(3) 6 (1分)
解析试题分析:设n(Al3+)=n(Al(OH)3)=x,则
由Al(OH)3+OH-═AlO2-+2H2O
1 1
x (3.6-3)mol解得x=0.6mol
设n(Fe3+)=y,则
Al3++3OH-═Al(OH)3↓
0.6mol 1.8mol
Fe3++3OH-═Fe(OH)3↓
1 3
y (3-1.8)mol解得y=0.4mol
则c(FeCl3)=0.4/0.1=4mol/L,c(AlCl3)=0.6/0.1=6mol/L
由Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓可知,a点的沉淀为Fe(OH)3和Al(OH)3,
则a点沉淀的总物质的量为0.4+0.6=1mol。
考点:铁、铝的重要化合物;化学方程式的有关计算;铁的氧化物和氢氧化物。
点评:本题考查金属及化合物的性质,明确发生的化学反应与图象的对应关系是解答本题的关键,然后利用消耗的NaOH的物质的量代入离子反应方程式计算即可解答。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入80mL 浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入80mL 浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.| 0.32 |
| n |
| 0.32 |
| n |
查看答案和解析>>
科目:高中化学 来源: 题型:




| b |
| 18 |
| 5n |
| 22.4×9 |
| b |
| 18 |
| b |
| 18 |
| 5n |
| 22.4×9 |
| b |
| 18 |
查看答案和解析>>
科目:高中化学 来源:读想用 高二化学(上) 题型:038
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1 mol,在此溶液中加入90 mL 4 mol·L-1的NaOH溶液,使其充分反应,设Al3+物质的量与总物质的量的比值为x.
(1)计算溶液中产生的沉淀只有Fe(OH)3时x的取值范围.请在坐标图中作出沉淀总量(mol)随x(0→1)变化的曲线.

(2)若Fe3+和Al3+物质的量之和为A mol(A为合理数值),其他条件不变时,求沉淀中同时有Fe(OH)3和Al(OH)3的x取值范围和各沉淀的物质的量(用含A、x的式子表示).
查看答案和解析>>
科目:高中化学 来源:2011-2012年海南省海南中学高二下学期期中考试文科化学试卷(带解析) 题型:填空题
(12分)现有一包AlCl3和FeCl3的混合粉末,欲将其中的Al元素和Fe元素分开,可进行如下操作: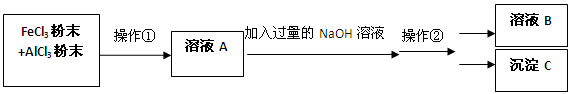
(1) 操作①名称是 ,操作②名称是 (过滤/分液/蒸馏/溶解/结晶);
(2)溶液B是 ,沉淀C是
(3)若往溶液A中滴入KSCN溶液,预计会观察到溶液呈 色;
(4)请写出在溶液中,FeCl3和NaOH反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源:2011-2012年海南省高二下学期期中考试文科化学试卷(解析版) 题型:填空题
(12分)现有一包AlCl3和FeCl3的混合粉末,欲将其中的Al元素和Fe元素分开,可进行如下操作:

(1) 操作①名称是 ,操作②名称是 (过滤/分液/蒸馏/溶解/结晶);
(2)溶液B是 ,沉淀C是
(3)若往溶液A中滴入KSCN溶液,预计会观察到溶液呈 色;
(4)请写出在溶液中,FeCl3和NaOH反应的离子方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com