
现有常温下的四种溶液(如下表),下列有关叙述正确的是( )
① | ② | ③ | ④ | |
氨水 | 氢氧化钠 | 醋酸 | 盐酸 | |
pH | 11 | 11 | 3 | 3 |
A.分别加水稀释10倍,四种溶液的pH为:①>②>③>④
B.温度上升10℃,四种溶液的pH不变
C.③④中分别加入适量的氯化按晶体后,③的pH减小,④的pH不变
D.将①④两种溶液等体积混合,所得溶液中c (C1-) >c NH4+)>c (H+)>c (OH- )
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年黑龙江牡丹江中学高二上期中理化学卷(解析版) 题型:选择题
在90℃时,将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=11,则V1∶V2为(已知在90℃时,水的离子积为10-12)( )
A.2:9 B.10:9 C.9:2 D.9:10
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第三次月考化学试卷(解析版) 题型:选择题
新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于新能源
①煤 ②石油 ③太阳能 ④生物质能 ⑤氢能
A.①②③ B.①②⑤ C.②③⑤ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高一上期中化学卷(解析版) 题型:选择题
下列说法正确的 是
是
A.如果5.6LN2含有n个氮分子,则NA一定约为4n
B.18g水中所含的电子数是8NA
C.在0.5mol/L的氯化钡溶液中含有离子数为1.5NA
D.15gCH3+含有8mol电子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期中化学试卷(解析版) 题型:填空题
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
化学式 | HSCN | CH3COOH | HCN | H2CO3 | HClO |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 6.2×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:Ka1=____________。
(2)物质的量浓度均为0.1mol/L的六种溶液:
A.CH3COONa、b.Na2CO3、c.NaClO、D.NaHCO3、e.NaSCN f.NaCN
pH由大到小的顺序为___________(用编号填写)。
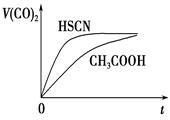
(3)25℃时,将20mL0.1mol·L-1CH3COOH溶液和20mL0.1mol·L-1HSCN溶液分别与20mL 0.1mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示。反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”)
(4)25℃时,NaCN与HCN的混合溶液,若测得pH=8,则溶液中
c(Na+)-c(CN-)=________mol/L(填代入数据后的计算式,不必算出具体数值)。
c(CN-)/c(HCN)=____________(填代入数据后的计算式,不必算出具体数值)。
(5)向NaClO溶液中通入少量的CO2,发生反应的离子方程式为_____________。
(6) 25C时,0.18mol/L醋酸钠溶液的pH约为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期中化学试卷(解析版) 题型:选择题
pH相同的等体积的两份溶液A和B; A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氧气的质量相同,则下列说法正确是的( )
①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A = B
④反应过程的平均速率B>A
⑤盐酸里有锌剩余
⑥醋酸里有锌剩余
A.③④⑤ B.③④⑥ C.③④⑥ D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期中化学试卷(解析版) 题型:选择题
将2molSO2、1molO2充入带活塞的密闭容器中,发生反应2SO2 (g) +O2(g)  2SO3 (g),达到平衡后,改变下列条件,SO3的平衡浓度不改变的是( )
2SO3 (g),达到平衡后,改变下列条件,SO3的平衡浓度不改变的是( )
A.保持溫度和容器的容积不变,充入2molSO2、1molO2
B.保持温度和容器的压强不变,充入1molSO3 (g)
C.其他条件不变的情况下改用绝热容器
D.保持温度和容器的压强不变,充入1molAr同时使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上期中化学试卷(解析版) 题型:选择题
某酸性溶液中只有Na+、CH3COO﹣、H+、OH﹣四种离子.则下列描述正确的是
A.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液可由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量NaOH,溶液中离子浓度为c(CH3COO﹣)>c(Na+ )>c(OH﹣)>c(H+)
D.加入适量氨水,c(CH3COO﹣)一定大于c(Na+)、c(NH4+)之和
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上期中化学卷(解析版) 题型:实验题
硫代硫酸钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图1所示。

已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示,
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装置气密性的操作是 。
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的 (填编号)。
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18. 00 mL。部分反应的离子方程式为:Cr2O72- + 6 I- + 14H+ = 2 Cr3+ + 3 I2 + 7 H2O;I2 + 2 S2O32- = S4O62-+2I-。则该废水中Ba2+的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com