
【题目】铜、银和金是日常生活中常用金属
(1)基态铜原子的价层电子排布式为___________。
(2)银氨溶液主要成分是[Ag(NH3)2]OH,配制方法是,向AgNO3溶液中滴加氨水至沉淀刚好完全溶解为止,得到澄清的银氨溶液
①AgNO3中阴离子的空间构型是_______________;
②[Ag(NH3)2]+中银离子的配位数为___________;NH3分子中N的杂化类型是__________。
③与NH3互为等电子体的离子有_____________。
(3)现代工业冶金中,2Au(CN)![]() +Zn=2Au+Zn(CN)
+Zn=2Au+Zn(CN)![]() 。CN-是常见的配体,提供孤电子对是C不是N,其主要原因是_________________________________。
。CN-是常见的配体,提供孤电子对是C不是N,其主要原因是_________________________________。
(4)铜、银是有机反应常见的催化剂如CH3CH2OH![]() CH3CHO+H2O。CH3CH2OH的沸点高于CH3CHO的主要原因是_____________________________________________。
CH3CHO+H2O。CH3CH2OH的沸点高于CH3CHO的主要原因是_____________________________________________。
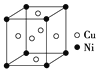
(5)一种铜镍合金(俗称白铜)的晶胞如图所示,铜、镍原子个数比为___________。
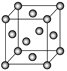
(6)金晶胞如图所示,这种晶体堆积方式称为___________堆积。该晶胞中原子空间利用率(φ)为___________ (用含π的式子表示),(提示原子空间利用率=![]() )。
)。
【答案】3d104s1 平面三角形 2 sp3 H3O+ C的电负性比N小,吸引孤电子对的能力比N弱 乙醇分子间形成氢键 3∶1 面心立方最密 ![]() π
π
【解析】
(1)铜原子有29个电子,其3d、4s能级上的电子为其价电子;
(2)①根据价层电子对互斥理论判断微粒空间构型;
②配位数等于配位原子个数,NH3中N原子是配位原子,NH3分子中N价层电子对个数是4,根据价层电子对互斥理论判断N原子杂化类型;
③等电子体原子个数和价电子总数相同,与氨气分子互为等电子体的微粒中含有4个原子、价电子数是8;
(3)提供孤电子对形成配位键具备两个条件,一是有孤电子对,二是配位原子的电负性不能太大;
(4)能形成分子间氢键的物质熔沸点较高;
(5)根据均摊法判断;
(6)该晶体为面心立方最密堆积;根据公式原子空间利用率=![]() 计算;
计算;
(1)铜原子有29个电子,电子排布要遵循洪特规则的特例。基态铜原子的价层电子排布式为3d104s1;
(2)①NO3-形成3个σ键,或价层电子对为3+![]() =3,且不含孤电子对,根据价层电子对互斥理论判断微粒空间构型为平面三角形。
=3,且不含孤电子对,根据价层电子对互斥理论判断微粒空间构型为平面三角形。
②配位数等于配位原子个数,NH3中N原子是配位原子;[Ag(NH3)2]+中银离子的配位数为2;NH3分子中N的杂化类型是sp3杂化。
③等电子体的原子个数和价电子总数均相同,与NH3互为等电子体的离子有H3O+等。
(3)提供孤电子对形成配位键具备两个条件,一是有孤电子对,二是配位原子的电负性不能太大,如CO、CN-等配体中C提供孤电子对,因为C的电负性比N、O的小。
(4)乙醇分子间形成氢键。
(5)面心立方中,顶点贡献率为1/8,面心贡献率为![]() ,一个晶胞含3个铜原子、1个镍原子,因此铜、镍原子个数比为3∶1。
,一个晶胞含3个铜原子、1个镍原子,因此铜、镍原子个数比为3∶1。
(6)设金原子半径为r,晶胞参数为a。面心立方晶胞中,面对角线上3个金原子相切,有:(4r)2=2a2,r=![]() a,1个金晶胞含4个金原子,φ=
a,1个金晶胞含4个金原子,φ=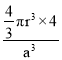 =
=![]() π。
π。


科目:高中化学 来源: 题型:
【题目】实验室用少量的溴和足量的乙醇制备1,2二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1,2二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -116 |
回答下列问题:
(1)写出该实验过程中发生的所有主要反应的化学方程式____;
在此制各实验中,要尽可能迅速地把反应温度170℃左右,其最主要目的是___(填正确选项前的字母,下同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入__,其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层,若产物中有少量未反应的Br2,最好用____洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(4)若产物中有少量副产物乙醚。可用____的方法除去,加热方式为____。
(5)反应过程中应用___冷却装置D
A.冰水混合物 B.室温下的水 C.60℃ D.100℃
查看答案和解析>>
科目:高中化学 来源: 题型:
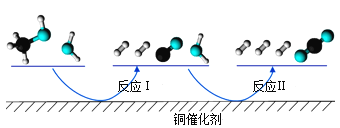
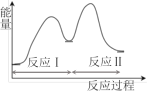
【题目】多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:
下列说法正确的是( )
A.反应Ⅱ的热化学方程式为:CO(g)+H2O(g)=H2(g)+CO2(g) △H=+akJ/mol(a>0)
B.1molCH3OH(g)和1molH2O(g)的总能量大于1molCO2(g)和3molH2(g)的总能量
C.选择优良的催化剂降低反应Ⅰ和Ⅱ的活化能,有利于减少过程中的能耗
D.CO(g)在反应中生成又消耗,CO(g)可认为是催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol/L的NH4Cl溶液中,离子浓度关系正确的是
A.c(![]() )>c(Cl—)>c(H+)>c(OH—)
)>c(Cl—)>c(H+)>c(OH—)
B.c(![]() )>c(OH—)>c(Cl—)>c(H+)
)>c(OH—)>c(Cl—)>c(H+)
C.c(OH—)=c(Cl—)+c(H+)
D.c(![]() )+c(H+)=c(Cl—)+c(OH—)
)+c(H+)=c(Cl—)+c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3是中学化学中常见的物质,在生产生活中有重要的用途
(1)常温下,0.1mol/L碳酸钠溶液pH约为12。原因是_____(用离子方程式表示)。
(2)若在FeCl3溶液中加入碳酸氢钠浓溶液,观察到红褐色沉淀和无色气体,用离子方程式解释产生该现象的原因________。
(3)工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3,再经过处理最终得到Pb。
①PbCO3的溶解度______PbSO4(填“大于”或“小于”)。
②用离子方程式解释Na2CO3的作用________。
③用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大。原因是________。
(4)25℃时,在10mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示:

①请写出OAB段的离子方程式________。
②当pH=7时,溶液中主要含有哪些离子________。(除H+和OH-外)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
A.将稀氨水逐滴加入稀硫酸中,当溶液的![]() 时,
时,![]()
B.两种醋酸溶液的物质的量浓度分别为![]() 和
和![]() ,pH分别为a和
,pH分别为a和![]() ,则
,则![]()
C.![]() 的NaOH溶液与
的NaOH溶液与![]() 的醋酸溶液等体积混合,滴入石蕊溶液呈红色
的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向![]() 的氨水中加入少量硫酸铵固体,则溶液中
的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,根据三种酸的电离平衡常数,下列判断正确的是![]()
酸 | HX | HY | HZ |
|
|
|
|
A.三种酸的强弱关系: ![]()
B.反应 ![]() 能够发生
能够发生
C.相同温度下,![]() 的NaX、NaY、NaZ溶液,NaZ溶液pH最大
的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,![]() 溶液的电离常数大于
溶液的电离常数大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
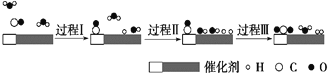
【题目】我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
下列说法正确的是( )
A.图示显示:起始时的2个H2O最终都参与了反应
B.过程Ⅰ、过程Ⅱ均为放热过程
C.过程Ⅲ只生成了共价化合物
D.使用催化剂降低了水煤气变换反应的ΔH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() 在恒容容器中进行,达到平衡状态的标志是( )
在恒容容器中进行,达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 、
、![]() 、
、![]() 的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥B.②③⑤C.①③④D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com