
【题目】聚合氯化铝([Al2( OH)nCl6-n]m}是一种新型高效净水剂,与一般絮凝剂相比,它的吸附能力强、絮凝率高,可由AlCl3经水解法制得。回答下列问题:
(1)工业上可用Cl2、Al2O3和焦炭在高温下反应制取AlCl3![]()
已知:4Al(s)+3O2(g)=2Al2O3(s) △H1
2C(s)+O2(g)=2CO(g) △H2
2Al(s)+3Cl2(g)=2A1Cl3(g) △H3
①Al2O3(s)+3C(s)+3Cl2(g) ![]() 2AlCl3(g)+3CO(g) △H=____________________。
2AlCl3(g)+3CO(g) △H=____________________。
②反应3A12O3(s)+6Cl2(g) ![]() 4AlCl3(g)+3O2(g)在高温下较难发生,但加入焦炭后可提高氯气的转化率,原因是_________________________________。
4AlCl3(g)+3O2(g)在高温下较难发生,但加入焦炭后可提高氯气的转化率,原因是_________________________________。
(2)AlCl3在水溶液中分三步水解
Al3++H2O![]() Al(OH)2++H+ K1
Al(OH)2++H+ K1
Al(OH)2++H2O![]() Al(OH)2++H+ K2
Al(OH)2++H+ K2
Al(OH)2++ H2O![]() Al(OH)3+H+ K3
Al(OH)3+H+ K3
①K1、K2、K3由小到大的顺序是_______________________。
②控制溶液的pH在一定范围内,上述水解产物才能聚合生成聚合氯化铝。pH偏小时,Al3+的水解程度弱;pH偏大时的影响是___________________________。
(3)已知有如下可逆反应: ![]()
![]()
298K时,将1mL 1 mol·L-1 AlCl3溶液与1mL2 a mol ·L-1H2QSI溶液混合发生上述反应,溶液中c[Al(HQSI)2+]与时间(t)的关系如图所示。
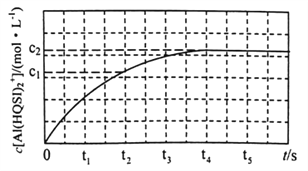
①下列可判断该反应达到平衡状态的是______________(填标号)。![]()
A.溶液的pH不再变化 B. v(Al3+)=v [Al(HQSI)2+]
C.溶液颜色不再变化 D.c(A13+)/c(H2QSI)不再变化
②0~t2时间内,该反应的平均反应速率v(H2QSI)= _________________。
③298K时,该反应的平衡常数K=_________________。
(4)该方法制得的聚合氯化铝的优点是不含其它金属离子,但盐基度低(盐基度:衡量絮凝剂絮凝效果的重要指标,定义式为:盐基度=n(OH)/3n(Al),n为物质的量)。常温下实验测量样品的盐基度,取m g样品,该样品中Al的质量分数为w;加入煮沸后冷却的蒸馏水溶解,配成1L溶液,测得该溶液pH=9.0。则其盐基度为________________。
【答案】 ![]() △H2+△H3-
△H2+△H3-![]() △H1 焦炭与O2反应,降低O2的浓度,导致反应不断地向正反应方向进行 K3<K2<K1(1分) 形成氢氧化铝沉淀 A、C; 2c1/t2 mol/(L·s)
△H1 焦炭与O2反应,降低O2的浓度,导致反应不断地向正反应方向进行 K3<K2<K1(1分) 形成氢氧化铝沉淀 A、C; 2c1/t2 mol/(L·s) 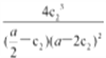
![]() )
)
【解析】(1)已知:Ⅰ4Al(s)+3O2(g)=2Al2O3(s) △H1
Ⅱ2C(s)+O2(g)=2CO(g) △H2
Ⅲ2Al(s)+3Cl2(g)=2A1Cl3(g) △H3
根据盖斯定律,由![]() 得反应①Al2O3(s)+3C(s)+3Cl2(g)
得反应①Al2O3(s)+3C(s)+3Cl2(g) ![]() 2AlCl3(g)+3CO(g) △H=
2AlCl3(g)+3CO(g) △H=![]() △H2+△H3-
△H2+△H3-![]() △H1;②反应3A12O3(s)+6Cl2(g)
△H1;②反应3A12O3(s)+6Cl2(g) ![]() 4AlCl3(g)+3O2(g)在高温下较难发生,但加入焦炭后可提高氯气的转化率,原因是焦炭与O2反应,降低O2的浓度,导致反应不断地向正反应方向进行;(2) ①盐类的水解分步进行且水解程度逐步减弱,故K1、K2、K3由小到大的顺序是K3<K2<K1;②pH偏大时Al3+水解形成氢氧化铝沉淀;(3) A.根据反应
4AlCl3(g)+3O2(g)在高温下较难发生,但加入焦炭后可提高氯气的转化率,原因是焦炭与O2反应,降低O2的浓度,导致反应不断地向正反应方向进行;(2) ①盐类的水解分步进行且水解程度逐步减弱,故K1、K2、K3由小到大的顺序是K3<K2<K1;②pH偏大时Al3+水解形成氢氧化铝沉淀;(3) A.根据反应![]() ,溶液的pH不再变化,氢离子浓度不再变化,则反应达平衡状态,选项A正确;B. v(Al3+)=v [Al(HQSI)2+],没有说明是正反应速率还是逆反应速率,不能确定正逆反应速率相等,不一定达平衡状态,选项B错误;C.反应中只有Al(HQSI)2+为有色配合物,溶液颜色不再变化,说明各浓度保持不变,反应达平衡状态,选项C正确;D.开始投料比1:2与反应计量数相等,故反应后c(A13+)/c(H2QSI)保持1:2,故比值不再变化不能说明反应达平衡,选项D错误。答案选AC;②由图中信息可知,0~t2时间内,该反应的平均反应速率v(H2QSI)=2 v[Al(HQSI)2+]=
,溶液的pH不再变化,氢离子浓度不再变化,则反应达平衡状态,选项A正确;B. v(Al3+)=v [Al(HQSI)2+],没有说明是正反应速率还是逆反应速率,不能确定正逆反应速率相等,不一定达平衡状态,选项B错误;C.反应中只有Al(HQSI)2+为有色配合物,溶液颜色不再变化,说明各浓度保持不变,反应达平衡状态,选项C正确;D.开始投料比1:2与反应计量数相等,故反应后c(A13+)/c(H2QSI)保持1:2,故比值不再变化不能说明反应达平衡,选项D错误。答案选AC;②由图中信息可知,0~t2时间内,该反应的平均反应速率v(H2QSI)=2 v[Al(HQSI)2+]=![]() mol/(L·s);③298K时,将1 mol ·L-1 AlCl3溶液与1mL2a mol ·L-1H2QSI溶液混合发生上述反应,达平衡时c(A13+)=(
mol/(L·s);③298K时,将1 mol ·L-1 AlCl3溶液与1mL2a mol ·L-1H2QSI溶液混合发生上述反应,达平衡时c(A13+)=(![]() ,c(H2QSI)= (
,c(H2QSI)= (![]() ,c[Al(HQSI)2+]=
,c[Al(HQSI)2+]=![]() ,c(H+)=
,c(H+)=![]() ,反应的平衡常数K=
,反应的平衡常数K=![]() ;(4)配成1L溶液,pH=9.0。则c(OHˉ)=10-5mol/L,其盐基度为n(OH)/3n(Al)=
;(4)配成1L溶液,pH=9.0。则c(OHˉ)=10-5mol/L,其盐基度为n(OH)/3n(Al)=![]() =
=![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为: C(s)+O2(g)=CO2(g)△H1=﹣393.5kJmol﹣1
H2(g)+ ![]() O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1
O2(g)=H2O(g)△H2=﹣242.0kJmol﹣1
CO(g)+ ![]() O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1
O2(g)=CO2(g)△H3=﹣283.0kJmol﹣1
根据以上数据,写出C(s)与水蒸气反应生成CO(g)和H2(g)的热化学方程式: .
(2)已知白磷和PCl3的分子结构如图所示,现提供以下化学键键能: P﹣P 198kJmol﹣1 , Cl﹣Cl 243kJmol﹣1 , P﹣Cl 331kJmol﹣1 .
则反应P4(白磷,s)+6Cl2(g)=4PCl3(s)的反应热△H= . 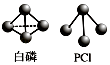
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修5:有机化学基础]化合物M是合成香精的重要原料。实验室由A和芳香烃E制备M的一种合成路线如下:

已知:![]()
请回答下列问题:
(1)A的化学名称为___________,F的结构简式为______________。
(2)B中官能团的名称为______________。
(3)F→G的反应类型为__________________。
(4)D+G→M的化学方程式为_________________。
(5)写出同时满足下列条件的D的同分异构体的结构简式___________。
①能发生水解反应和银镜反应
②不含环状结构
③核磁共振氢谱有4组峰
(6)参照上述合成路线和信息。以![]() 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备 的合成路线______________________。
的合成路线______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 1.4gC2H4、C3H6的混合气体中,所含碳原子总数为0.lNA
B. 在0.1 mol·L Na2S溶液中,S2-、HS-、H2S微粒总数为0.1NA![]()
C. 标准状况下,22.4LC2H6中所含极性共价键的数目为7NA
D. 50mL l2mol·L的浓盐酸与足量MnO2反应,转移电子总数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是短周期周期表的一部分①~⑨是元素周期表的部分元素。

请回答下列问题:
(1) ③、⑤、⑥对应的原子半径最大的是_____(写元素名称)
(2)元素⑤和⑧形成的化合物的电子式是_____,该化合物溶于水被破杯的化学键类型为_______。
(3)元素⑥和⑨的最高价氧化物对应的水化物发生反应的离子方程式是________。
(4)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一稗常见的氧化剂,已知液态A与液态B充分反应生成已知液态10电子分子和一种气态单质,写出A与B反应的化学方程式:______________。
(5)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:

①溶液c的作用是____________。
②溶液b是(填化学式)_____。写出溶液b中发生反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应,且能量变化如图所示的是( ) 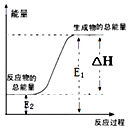
A.锌粒和稀硫酸反应
B.灼热的木炭与CO2反应
C.甲烷在空气中燃烧的反应
D.Ba(OH)28H2O晶体与NH4Cl晶体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇属于可再生能源,可代替汽油作为汽车燃料,下列热化学方程式中的反应热能够正确表示甲醇燃烧热的是( )
A.CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=+726.5kJ/mol
O2(g)═CO2(g)+2H2O(l)△H=+726.5kJ/mol
B.CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol
O2(g)═CO2(g)+2H2O(l)△H=﹣726.5kJ/mol
C.CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(g)△H=﹣675.3kJ/mol
O2(g)═CO2(g)+2H2O(g)△H=﹣675.3kJ/mol
D.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=﹣1453kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大。Z在短周期主族元素中原子半径最大;m、n、p、q为它们的单质;常温下,q为黄绿色气体,a为无色液体;各物质间转化关系如图所示。下列说法不正确的是
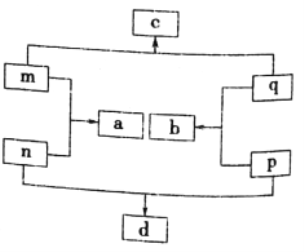
A. d中可能含有非极性共价键
B. Y、Z、W分别与X形成的化合物沸点:Z<Y<W
C. m在q中燃烧,产生大量白雾
D. 元素非金属性:Y>W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组对采集的酸雨样品进行化验,测得数据如下:c(Na+)=5.0×10-6 mol/L、c(NH4+)=2.0×10-5 mol/L、c(NO3-)=2.0×10-4 mol/L、c(SO42-)=4.0×10-4 mol/L,H+和OH-浓度未测定,则此酸雨的pH约为
A.3 B.4 C.5 D.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com