
【题目】(1)物质的量浓度相同的下列物质的溶液①NH4Cl ②NH4HSO4③CH3COONH4,c(NH4+)由小到大的顺序是_______________(填序号)。
(2)同浓度的下列溶液:①CH3COONH4②NH4Cl ③Na2CO3④NaHCO3,其中pH由大到小的顺序 是_________________。
(3)物质的量浓度相同的 ①盐酸、②硫酸溶液、 ③醋酸(CH3COOH)溶液各100 mL分别与足量的Zn反应,在相同的条件下,产生H2的体积分别为V1、V2、V3,它们由大到小的顺序是____________。
(4)CH3COONa溶液呈_____性(填“酸”、“碱”或“中”),其原因是______(用离子方程式表示)。
(5)常温时,若10体积pH1=a的盐酸溶液与1体积pH2=b的氢氧化钠溶液混合后溶液呈中性,则混合前该强酸的pH1与强碱的pH2之间应满足的关系是_________________。
【答案】③①② ③④①② V2>V3= V1 碱 CH3COO-+H2O![]() CH3COOH+OH- a+b=15或pH1+pH2=15
CH3COOH+OH- a+b=15或pH1+pH2=15
【解析】
(1)NH4Cl 溶液中Cl-对 NH4+的水解无影响,NH4HSO4溶液中的HSO4-电离溶液显酸性,抑制了NH4+的水解,NH4+的浓度较大,CH3COONH4溶液中CH3COO-水解溶液显碱性,会促进NH4+的水解,使得NH4+的浓度较小,所以NH4+离子浓度由大到小的顺序是③①②;
(2)CH3COO-和NH4+水解程度相当,溶液略显中性,NH4Cl溶液中NH4+的水解使得溶液向酸性, Na2CO3和NaHCO3溶液由于CO32-和HCO3-的水解使得溶液显碱性,但是CO32-比HCO3-的水解程度要大,所以Na2CO3溶液的碱性比NaHCO3要强,故pH 由大到小的顺序 是③④①②;
(3)盐酸和醋酸是一元酸,物质的量浓度和体积相同时能够电离出来的H+的物质的量相同,与Zn反应放出的气体相等,硫酸是二元酸,物质的量浓度和体积相等时比盐酸、醋酸能电离出更多的H+,所以放出的气体更多,V1、V2、V3故由大到小的顺序是V2>V3= V1;
(4)CH3COONa溶液呈碱性,原因是CH3COO-水解使得溶液显碱性,离子方程式为:CH3COO-+H2O![]() CH3COOH+OH-;
CH3COOH+OH-;
(5)pH1=a的盐酸溶液中c(H+)=10-amol/L,pH2=b的氢氧化钠溶液中c(OH-)=10b-14mol/L,10体积pH1=a的盐酸溶液与1体积pH2=b的氢氧化钠溶液混合后溶液呈中性,则有10×10-a=1×10b-14,得a+b=15,或pH1+pH2=15。


科目:高中化学 来源: 题型:
【题目】硝酸铈铵、磷酸锰铵是两种重要的复盐,在工农业生产中具有广泛应用。
(1) 复盐是由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐。下列物质属于复盐的是________(填序号)。
A.BaFe2O4 B.NaHSO4 C.KAl(SO4)2·12H2O D.Ag (NH3)2OH
(2) 硝酸铈铵[(NH4)2Ce(NO3)6]的制备方法如下:

①“氧化”得到CeO2的化学方程式为________________________________。
②证明CeO2已经洗涤干净的方法是_____________________________。
(3) 为测定磷酸锰铵[(NH4)aMnb(PO4)c·xH2O]的组成,进行如下实验:①称取样品2.448 0 g,加水溶解后配成100.00 mL溶液A;②量取25.00 mL溶液A,加足量NaOH溶液并充分加热,生成NH3 0.067 20 L(标准状况);③另取25.00 mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH 6 ~ 8,充分反应后,将溶液中Mn2+转化为Mn3O4,得Mn3O4 0.2290 g。通过计算确定该样品的化学式(写出计算过程) __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的名称为3-甲基丁烷
的名称为3-甲基丁烷
B. 淀粉和纤维素的化学式均为(C6H10O5)n,故两者互为同分异构体
C. ![]() 和
和![]() 为同一种物质
为同一种物质
D. HCOOH与OHCCH2OH属于同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如图1所示。
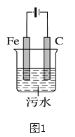
回答下列问题:
(1)电解过程中,电解池阴极的电极反应式为______;控制电流,可使电解池阳极同时发生两个电极反应:其中一个为2H2O -4e- === O2↑+ 4H+,另一个电极反应式为______。
(2)电解池溶液中得到Fe(OH)3沉淀的离子方程式为______。
(3)某熔融盐燃料电池以熔融的多种碱金属碳酸盐混合物为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极,如图2。若该熔融盐燃料电池为电浮选凝聚法的电解电源,则:
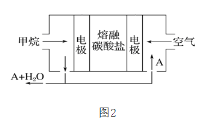
①正极的电极反应式为______;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是______。
③实验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池理论上消耗CH4______L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用k表示).下表是25℃下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.96×10-5 |
HClO | HClO | 3.0×10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H2SO3 | H2SO3 HSO3- | K1=1.54×10-2 K2= 1.02×10-7 |
回答下列问题:
(1)CH3COOH、HClO、H2CO3、HCO3-、H2SO3、HSO3-都可看作是酸,其中酸性最强的是_________,最弱的是________________。
(2)向Na2CO3溶液中通入足量的氯气,发生的离子方程式为______________________,向NaClO溶液中通入少量的二氧化硫,发生的离子方程式为____________________________________。
(3)求25℃时,1.2mol/L 的NaClO溶液pH=____________(己知:lg2=0.3),0.10mol/L的CH3COOH溶液中的c(H+)=______________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是( )
A.2HI+Cl2=2HCl+I2
B.CH4+2O2![]() CO2+2H2O
CO2+2H2O
C.CH2Br2+Cl2![]() CHClBr2+HCl
CHClBr2+HCl
D.Zn+CuSO4=ZnSO4+Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原铁粉主冶惊痫、癫狂、脚气冲心、贫血等。某兴趣小组用氢气和碳酸亚铁反应制取还原铁粉并检验其他产物,实验装置如图![]() 部分支持装置省略
部分支持装置省略![]() ,下列说法正确的是
,下列说法正确的是![]()
![]()
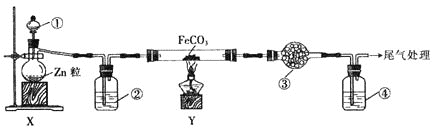
A.![]() 、
、![]() 、
、![]() 、
、![]() 中依次盛放稀
中依次盛放稀![]() 、浓
、浓![]() 、无水硫酸铜、澄清石灰水
、无水硫酸铜、澄清石灰水
B.装置![]() 、
、![]() 的作用分别是检验
的作用分别是检验![]() ,吸收多余的
,吸收多余的![]()
C.加热Y装置前,应先让蒸馏烧瓶中反应一段时间,排出装置中的空气
D.装置X可直接用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com