
| A、O2的结构式为 O-O |
B、硫离子的结构示意图为: |
C、CCl4分子的比例模型: |
D、H2O的电子式: |
 ,则其正确的结构式为:O=O,故A错误;
,则其正确的结构式为:O=O,故A错误; ,故B正确;
,故B正确;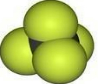 ,故C错误;
,故C错误; ,故D错误;
,故D错误;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、S→SO3→H2SO4→Na2SO3 |
| B、Al→Al(OH)3→Al2O3→NaAlO2 |
| C、Na→Na2O2→Na2CO3→NaOH |
| D、Si→SiO2→H2SiO3→Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,反应4Na(s)+O2(g)═2Na2O(s)的△H<0,△S>0 | |||
| B、反应2A(g)+B(g)═3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H<0 | |||
| C、合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 | |||
D、反应2SO2+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2S水溶液在空气中变浑浊 |
| B、生活中使用明矾净水,除去水中的悬浮颗粒 |
| C、溶有二氧化氮的浓硝酸做火箭的助燃剂 |
| D、漂白粉漂白有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A、X元素在周期表中的位置是第三周期第Ⅱ族 |
| B、X和W能形成离子化合物 |
| C、Y的最高价氧化物对应的水化物能溶于稀氨水 |
| D、Z的氢化物的稳定性比W的氢化物的稳定性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
| B、CH2=CH2+Cl2+Ca(OH)2→CH2-CH2+CaCl2+H2O |
C、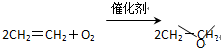 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com