
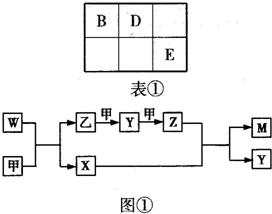
 A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中相对位置如表①所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子中含有10个电子.它们之间的转化关系如图①所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中相对位置如表①所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子中含有10个电子.它们之间的转化关系如图①所示.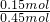 ×100%=33.3%;
×100%=33.3%;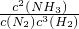 =
=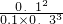 =3.7;
=3.7;

科目:高中化学 来源: 题型:
下下图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素。A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3∶4。根据以上信息回答下列问题:

(1)A用于工业制取硝酸所发生反应的化学方程式 。
(2)D的化学式是 。
(3)B在实验室中可以用于制取某种常见气体,其反应的化学方程式
为 。
(4)B与E反应可生成单质G和一种常见的液体H,其反应的化学方程式为
。
(5)用化学方程式表示C的另一种用途 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)
A.原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是 ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________。
(2)C的立体结构呈 ____ 形,该分子属于 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为_______ __________________ 。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________。
|
|
| A-B | A=B | A≡B |
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 |
(5)它们的分子中都包含___________个σ键,______________个π键。
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为 _____ 。Fe(CO)5常温下呈液态,熔点为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 ____(填晶体类型);Fe(CO)5是配合物,配体是__________ 。
B.茶中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6~7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、 ___ 、 ____ 等仪器。
步骤2中,改用试剂 _______ (写试剂名称)来调节pH将更为方便;判断沉淀已经洗净的方法是 。
步骤3中,滴定过程中,眼睛应注视 ____________________,被滴定的20 mL滤液中含CO32-的物质的量为 __ mol,试计算原500g茶叶中钙离子的质量分数为 _______ ,计算过程如下:
查看答案和解析>>
科目:高中化学 来源:福建省厦门双十中学2011届高三第一次月考化学试题 题型:填空题
(12分)奥运五环“象征五大洲的团结,全世界的运动员以公正、坦率的比赛和友好的精神,在奥运会上相见”。右下图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素。A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3∶4。根据以上信息回答下列问题:
(1)A用于工业制取硝酸所发生反应的化学方程式 。
(2)D的化学式是 ,E分子中含有 键和 键。
(3)B的水溶液呈弱酸性,其电离方程式可表示为 ,B在实验室中可以用于制取某种常见气体,其反应的化学方程式为 。
(4)B与E反应可生成单质G和一种常见的液体H,其反应的化学方程式为
。
(5)用化学方程式表示C的另一种用途 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省高三上学期第三次月考理综化学试卷(解析版) 题型:填空题
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) 。 (2)由A、B两种元素以原子个数比5∶1形成离子化合物X,X的电子式为 。
(3)由A、B元素形成的化合物B2A4可以与O2、KOH溶液形成原电池,该原电池负极的电极反应式为 。
(4)①若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式: 。②若E是非金属元素,其单质在电子工业中有重要应用,其氧化物晶体中E原子的杂化方式为 。 (5)由A、C、D、F四种元素形成的化合物Y(DAFC3)(已知A2FC3的Ka1=1.3×10-2、Ka2=6.3×10-8),则Y溶液中各离子浓度由大到小的顺序为 ;向Y溶液中加入一定量的NaOH,使溶液中c(AFC3-)=c(FC32-),则此时溶液呈 (填“酸性”、“碱性”或“中性”);用惰性电极电解Y的水溶液,阳极无气体产生,阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元索,它们的原子序数依次增大;A元索娃所有原子中半径最小的原子;B元索的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,
且与E同周期;E元素的最外层电子数娃其次外层电子数的3/4,A、B、D、E这四种元素中,每一种都与C元索形成原子个数比不相同的化合物。
请回答下列问题:
(l)C和E两元索相比较,非金属性较强的是 (填“元素名称”),可
以验证该结论的是 (填“序号”)。
A.比较这两种元索的气态氢化物的沸点
B.比较这两种元索的单质在常温下的状态
C.比较这两种元索的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)B元素的氢化物在催化剂存在的情况下与C元素单质反应的化学方程式为
。
(3)C、D两元素形成的原子个数比为1:1的化合物,E、C两元素形成的原子个数
比为1:2的化合物,该两种化合物反应的化学方程式为 。
(4)A、C、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为 。
(5)A与C、A与E可分别形成甲、乙两种负一价双原子离子,且甲有10个电子,乙有18个电子,则甲与乙反应的离子方程式为 。
(6)B元素的气态氢化物却其一种常见氧化物(双原于分子)能反应生成B的单质,
该反应中氧化产物与还原产物的物质的量之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com