
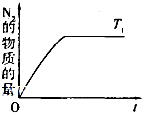
 导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中.利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一.| 0.62 |
| 0.52×0.25 |
| 0.25 |
| 2 |
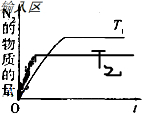 ,故答案为:CH4+4NO═2N2+CO2+2H2O;
,故答案为:CH4+4NO═2N2+CO2+2H2O; ;
;


科目:高中化学 来源: 题型:
| A、构成该电池的正极和负极必须是两种活性不同的金属 |
| B、充电时有CH3OH生成的电极为阴极 |
| C、放电时电解质溶液的pH逐渐增大 |
| D、充电时每生成1 mol CH3OH转移12 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50mL2mol/LCaCl2溶液 |
| B、100mL2moL/LNaCl溶液 |
| C、50mL4mol/LCaCl2溶液 |
| D、100mL4mol/LNaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠与水反应2O22-+2H2O=4OH-+O2↑ |
| B、铝与氢氧化钠溶液反应Al+OH-+H2O=AlO2-+H2↑ |
| C、硫酸铝和氨水反应Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| D、氯气与氢氧化钠溶液反应Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
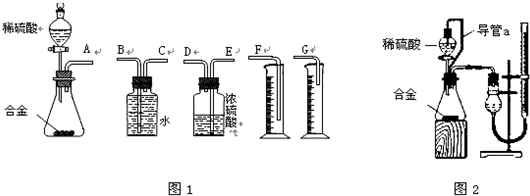
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤编号 | 实验操作 | 预期现象和结论 |
| 1. | 取少量溶液于试管中,滴入 | |
| 2. | 往装有沉淀的试管中加入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
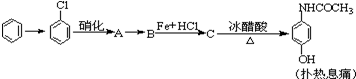
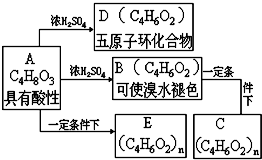 化合物C和E都是医用功能高分子材料,且组成中元素质量分数相同,均可由化合物A(C4H8O3)制得,如图所示.B和D互为同分异构体.
化合物C和E都是医用功能高分子材料,且组成中元素质量分数相同,均可由化合物A(C4H8O3)制得,如图所示.B和D互为同分异构体.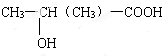 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com