
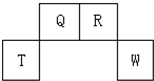
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.6 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
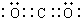 ,
,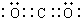 ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、分子中C、H、O的个数比为1:2:3 |
| B、该有机物的实验式一定为CH2 |
| C、该有机物的相对分子质量为14 |
| D、该分子中可能含有氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
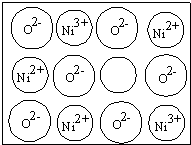 超细氧化镍(NiO)是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面.工业上常以Ni(NO3)2?6H2O和尿素[CO(NH2)2]为原料制备.
超细氧化镍(NiO)是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面.工业上常以Ni(NO3)2?6H2O和尿素[CO(NH2)2]为原料制备.查看答案和解析>>
科目:高中化学 来源: 题型:
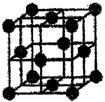 计算并填空:
计算并填空:| 1 |
| 2 |
| 化学键 | Si-O | O=O | Si-Si |
| 键能/kJ?mol-1 | X | 498.8 | 176 |
查看答案和解析>>
科目:高中化学 来源: 题型:
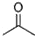 根据键线式回答下列问题:
根据键线式回答下列问题: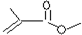 分子式:
分子式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.请填写下列空白:
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若D为CO,C能和E反应,则A一定不是单质 |
| B、若X是Na2CO3,C为CO2,则A一定是氯气,且D和E不反应 |
| C、若A是单质,B和D的反应是OH-+HCO3-=CO32-+H2O,则E是一种清洁的能源 |
| D、若C的相对分子质量比D小16,B可以使紫色石蕊试液变色,则D一定能与冷水反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com