
【题目】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g).若经2s 后测得C的浓度为 0.6molL﹣1 , 现有下列几种说法:①用物质A表示的反应的平均速率为 0.6mol(Ls)﹣1;②用物质B表示的反应的平均速率为 0.15mol(Ls)﹣1;③2s 时物质A的浓度为1.4molL﹣1;④2s 时物质B的转化率为70%.其中正确的是( )
A.①③
B.①④
C.②③
D.③④
【答案】C
【解析】①v(C)= ![]() =0.3molL﹣1s﹣1 , 速率之比等于化学计量数之比,故v(A)=v(C)=0.3molL﹣1s﹣1 , 故①错误;
=0.3molL﹣1s﹣1 , 速率之比等于化学计量数之比,故v(A)=v(C)=0.3molL﹣1s﹣1 , 故①错误;
②v(C)= ![]() =0.3molL﹣1s﹣1 , 速率之比等于化学计量数之比,故v(B)=
=0.3molL﹣1s﹣1 , 速率之比等于化学计量数之比,故v(B)= ![]() v(C)=
v(C)= ![]() ×0.3molL﹣1s﹣1=0.15molL﹣1s﹣1 , 故②正确;
×0.3molL﹣1s﹣1=0.15molL﹣1s﹣1 , 故②正确;
③△c(A)=△n(C)=0.6molL﹣1 , △n(A)=0.6molL﹣1×2L=1.2mol,平衡A的浓度c(A)= ![]() =1.4mol/L,故③正确;
=1.4mol/L,故③正确;
④根据方程式可知,△c(A)=△n(C)=0.6molL﹣1 , 故△n(A)=0.6molL﹣1×2L=1.2mol,△(B)= ![]() △n(A)=0.6mol,故B的转化率=
△n(A)=0.6mol,故B的转化率= ![]() ×100%=30%,故④错误;
×100%=30%,故④错误;
故选C.
【考点精析】解答此题的关键在于理解反应速率的定量表示方法的相关知识,掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】有下列反应:
①Fe+CuSO4=Cu+FeSO4 ②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4=BaSO4↓+2H2O ④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3 ![]() 2KCl+3O2↑ ⑥CaCO3
2KCl+3O2↑ ⑥CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2 ![]() 2CO2 ⑧SO 42- +Ba2+=BaSO4↓
2CO2 ⑧SO 42- +Ba2+=BaSO4↓
(1)既是分解反应又是氧化还原反应的是 , 既是化合反应又是氧化还原反应的是(均填序号)
(2)反应①中,氧化剂是;
(3)反应③的离子反应方程式为
(4)写出一个符合⑧的化学反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。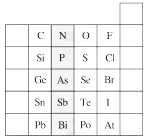
(1)阴影部分元素在元素周期表中的位置为族。
(2)根据元素周期律预测:H3AsO4属于强酸还是弱酸?。
(3)C和Si元素的氢化物都可以燃烧,但Si元素的氢化物在空气中可以自燃,其原因是。试写出Si的氢化物完全燃烧的化学方程式:。
(4)O2与H2的反应是不可逆反应,而S与H2反应有一定限度,请写出Se与H2反应的化学方程式:。
(5)试比较S、O、F三种元素的原子半径大小:(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是化学反应中的基本反应之一,研究氧化还原反应,对人类的进步具有极其重要的意义.
(1)已知:2BrO3﹣+C12═Br2+2C1O3﹣; 5C12+I2+6H2O═2HIO3+10HC1;C1O3﹣+5C1﹣+6H+═3C12+3H2O则C1O3﹣、BrO3﹣、IO3﹣、C12的氧化性由弱到强的排序为
(2)已知Fe3+的氧化性强于I2 , 请你从所给试剂中选择所需试剂,设计一个实验加以证明.(提示:请写出实验步骤、现象及结论)①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液
(3)二十世纪初期,化学家合成出极易溶于水的NaBH4 . 在强碱性条件下,常用NaBH4处理含Au3+的废液生成单质Au,已知,反应后硼元素以BO2﹣形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为
(4)某强氧化剂[RO(OH)2]+能将Na2SO3氧化.已知含2.0×10﹣3mol[RO(OH)2]+离子的溶液,恰好跟25.0mL 0.2mol/L 的Na2SO3溶液完全反应,则反应后R的化合价为价.
(5)将32g 铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:
①待产生的气体全部释放后,向溶液加入V mL amolL﹣1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为mol/L.(用含V、a的式子表示)
②欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3 , 至少需要H202的质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向装有碘水的试管中加CCl4振荡,静置后,你观察到的现象是
A. 上层几乎无色,下层紫红色 B. 上层紫红色,下层几乎无色
C. 上层几乎无色,下层橙色 D. 不分层,紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2 , 而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。 
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)装置①中发生反应的离子方程式是;
(2)装置②的目的是 , 发生反应的化学方程式是;
(3)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是 ;
(4)实验的具体操作是:先检验装置的气密性,再加入药品,然后(此操作的目的是),最后滴加浓硝酸;
(5)该小组得出的结论所依据的实验现象是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )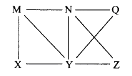
A.N一定是HCl(aq)
B.X可能为Al或Cl2
C.Y一定为NaOH(aq)
D.Q、Z中的一种必定为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型材料B4C,它可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A. B4C是一种原子晶体
B. B4C是一种离子晶体
C. B4C是一种分子晶体
D. B4C分子是由4个硼原子和1个碳原子构成的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com