
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | -定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA | |
| C. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| D. | 已知C2H4(g)+H2(g)=C2H6(g)△H=-137.0kJ/mol,乙烯与H2加成时放出68.5kJ热量,则 反应过程中被破坏的碳碳双键的数目为NA |
分析 A、25℃时,pH=13的氢氧化钡溶液中,氢氧根浓度为0.1mol/L;
B、二氧化硫和氧气的反应为可逆反应;
C、将1molNH4NO3溶于稀氨水中使溶液呈中性,则有n(OH-)=n(H+),根据电荷守恒来分析;
D、乙烯中含有一条碳碳双键.
解答 解:A、25℃时,pH=13的氢氧化钡溶液中,氢氧根浓度为0.1mol/L,故1L溶液中含有的氢氧根的物质的量为0.1mol,个数为0.1NA个,故A错误;
B、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故最终气体分子个数大于3NA个,故B错误;
C、将1molNH4NO3溶于稀氨水中,根据电荷守恒可知有:n(OH-)+n(NO3-)=n(H+)+n(NH4+),而溶液呈中性,则有n(OH-)=n(H+),故可知n(NO3-)=n(NH4+)=1mol,即铵根离子个数为NA个,故C正确;
D、由C2H4(g)+H2(g)=C2H6(g)△H=-137.0kJ/mol,可知乙烯与H2加成时放出68.5kJ热量时,反应掉0.5mol乙烯,而乙烯中含有一条碳碳双键,故被破坏的碳碳双键为0.5NA条,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:解答题
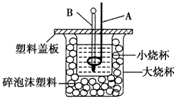 已知 H+(aq)+OH-(aq)═H O(l)△H=-57.3kJ•mol-1,回答下列有关中和反应的问题:(1)用 0.1mol Ba(OH)2 配成稀溶液与足量稀硝酸反应,能放出11.46kJ 的能量.
已知 H+(aq)+OH-(aq)═H O(l)△H=-57.3kJ•mol-1,回答下列有关中和反应的问题:(1)用 0.1mol Ba(OH)2 配成稀溶液与足量稀硝酸反应,能放出11.46kJ 的能量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是( )| A. | T1<T2,P1>P2,m+n>p△Η<0 | B. | T1>T2,P1<P2,m+n<p△Η>0 | ||
| C. | T1<T2,P1>P2,m+n<p△Η<0 | D. | T1>T2,P1<P2,m+n>p△Η>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 加入几小块CaCO3固体 | 有气泡产生 | |
| ② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
| ③ | 滴加少量溴水,振荡 | Ⅱ | |
| ④ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器甲中分子总数多 | B. | 容器甲中C的浓度大 | ||
| C. | 容器甲中反应速率快 | D. | 容器甲中转化率大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
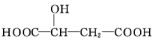 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸不能发生聚合反应 | |
| B. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| C. | 苹果酸分子的核磁共振氢谱有四组峰,峰面积之比为1:1:2:2 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com