
【题目】现有下列物质:①He;②N2;③H2O2;④CaO;⑤NaHCO3;⑥NH4Cl;⑦Na2O2;⑧SiO2;⑨MgCl2;⑩KOH。请用序号填空:
(1)只含离子键的物质是______________;
(2)只含共价键的物质是______________;
(3)既含离子键又含共价键的物质是______________;
(4)只含极性键的物质是______________;
(5)既含离子键又含非极性键的物质是______________;
(6)不存在化学键的物质是______________;
(7)属于离子化合物的是______________;
(8)属于共价化合物的是______________。
【答案】④⑨ ②③⑧ ⑤⑥⑦⑩ ⑧ ⑦ ① ④⑤⑥⑦⑨⑩ ③⑧
【解析】
一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,同种原子形成的是非极性共价键,不同种原子形成的是极性共价键,含离子键的一定为离子化合物,据此分析解答。
①He为单原子分子,不含化学键,属于单质;
②N2的电子式为![]() ,结构中含N≡N共价键,属于单质;
,结构中含N≡N共价键,属于单质;
③H2O2的电子式为![]() ,结构中H原子与O原子形成极性共价键,氧原子与氧原子形成非极性共价键,属于共价化合物;
,结构中H原子与O原子形成极性共价键,氧原子与氧原子形成非极性共价键,属于共价化合物;
④CaO的电子式为![]() ,结构中钙离子与氧离子形成离子键,属于离子化合物;
,结构中钙离子与氧离子形成离子键,属于离子化合物;
⑤NaHCO3中Na+与HCO3-之间形成离子键,HCO3-中存在极性共价键,属于离子化合物;
⑥NH4Cl的电子式为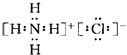 ,结构中NH4+与Cl-之间形成离子键,铵根中氮原子与氢原子之间形成极性共价键,属于离子化合物;
,结构中NH4+与Cl-之间形成离子键,铵根中氮原子与氢原子之间形成极性共价键,属于离子化合物;
⑦Na2O2的电子式为![]() ,结构中钠离子与过氧根形成离子键,过氧根中氧原子与氧原子之间形成非极性共价键,属于离子化合物;
,结构中钠离子与过氧根形成离子键,过氧根中氧原子与氧原子之间形成非极性共价键,属于离子化合物;
⑧SiO2属于原子晶体,结构中Si原子与氧原子形成极性共价键,属于共价化合物;
⑨MgCl2的电子式为![]() ,结构中镁离子与氯离子形成离子键,属于离子化合物;
,结构中镁离子与氯离子形成离子键,属于离子化合物;
⑩KOH的电子式为![]() ,结构中钾离子与氢氧根形成离子键,氢氧根中氧原子与氢原子形成极性共价键,属于离子化合物;
,结构中钾离子与氢氧根形成离子键,氢氧根中氧原子与氢原子形成极性共价键,属于离子化合物;
(1)只含离子键的物质是:④⑨;答案为④⑨。
(2)只含共价键的物质是:②③⑧;答案为②③⑧。
(3)既含离子键又含共价键的物质是:⑤⑥⑦⑩;答案为⑤⑥⑦⑩。
(4)只含极性键的物质是:⑧;答案为⑧。
(5)既含离子键又含非极性键的物质是:⑦;答案为⑦。
(6)不存在化学键的物质是:①;答案为①。
(7)属于离子化合物的是:④⑤⑥⑦⑨⑩;答案为④⑤⑥⑦⑨⑩。
(8)属于共价化合物的是:③⑧;答案为③⑧。


 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:  。
。
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_____;H、N、O三种元素的电负性由大到小的顺序是____。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4)②中所形成的配离子中含有的化学键类型有______(填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究煤的合理利用及 CO2的综合应用有着重要的意义。请回答以下问题:
I.煤的气化
已知煤的气化过程涉及的基本化学反应有:
①C(s)+H2O(g) ![]() CO(g)+H2(g) △H=+131kJ·mol-1
CO(g)+H2(g) △H=+131kJ·mol-1
②CO(g)+3H2(g) ![]() CH4(g) +H2O(g) △H=akJ·mol-1
CH4(g) +H2O(g) △H=akJ·mol-1
查阅资料反应②中相关化学键能数据如下表:
化学键 | C≡O | H—H | H—C | H—O |
E(kJ·mol-1) | 1072 | 436 | 414 | 465 |
(1)则反应②中 a =_____________。
(2)煤直接甲烷化反应 C(s) + 2 H2 (g) ![]() CH4(g) 的△H=为 _____kJ mol-1, 该反应在_____________(填“高温”或“低温 ”)下自发进行。
CH4(g) 的△H=为 _____kJ mol-1, 该反应在_____________(填“高温”或“低温 ”)下自发进行。
II.合成低碳烯烃
在体积为1 L 的 密闭容器中,充入 1mol CO2和 2 .5 mol H2, 发生 反应: 2CO2 ( g) + 6 H2(g)![]() C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,测得温度对催化剂催化效率和CO2 平衡转化率的影响如右图 所 示 :
C2H4(g)+4 H2O(g) △H=-128kJ·mol-1,测得温度对催化剂催化效率和CO2 平衡转化率的影响如右图 所 示 :
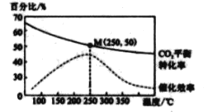
(3) 图中低温时, 随着温度升高催化剂的催化效率提高, 但 CO2的平衡转化率却反而降低 ,其原因是_______________.
(4) 250℃时,该反应的平衡常数K 值为____________。
III.合成甲醇
在恒温 2 L 容积不变的密闭容器中,充入 1molCO2 和 3 molH2, 发生反应:. CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g)+ H2O(g),测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(5) 反应前 1 小时内的平均反应速率 v(H2)为_______molL-1h-1 , 该温度下CO2的平衡转化率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图甲所示装置电解饱和食盐水制Cl2、H2和NaOH。
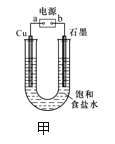
(1)b为电源的______极,Cu极的电极反应式为________。
(2)某同学在进行上述实验时,发现铜电极下方产生红色沉淀,石墨电极上产生无色无味的气体,则该同学将石墨连接到了电源的______极。
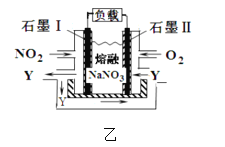
(3)电解粗铜制精铜时,可采用NO2、O2和熔融NaNO3制作的燃料电池作电源,其原理如图,该电池在使用过程中石墨 I电极上生成氧化物Y,则其正极的电极反应为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。
回答下列问题:
(1)基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式__。第三电离能:Ca__Ti(填“大于”或“小于”)。
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是__。
②O3分子的中心原子杂化类型为___;与O3互为等电子体的是__(任意写一种)。
(3)Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl![]() 2Na3OCl+H2↑,在该反应中,形成的化学键有__(填标号)。
2Na3OCl+H2↑,在该反应中,形成的化学键有__(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为anm,密度为dgcm3。

①Na3OCl晶胞中,O位于各顶点位置,Cl位于__位置。
②用a、d表示阿伏加德罗常数的值NA=__(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列几组物质中,互为同位素的有________,互为同素异形体的有________,互为同系物的有________,互为同分异构体的有________,属于同种物质的有________。
①O2和O3②35Cl和37Cl③CH3CH3和CH3CH2CH3④H2、D2和T2⑤CH3CH2CH(CH3)CH2CH3和CH3CH2CH2CH(CH3)CH3⑥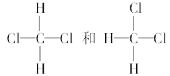
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验某溶液中是否含有SO![]() 的方法中正确的是( )
的方法中正确的是( )
A.向该溶液中加入酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO![]()
B.向该溶液中加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO![]()
C.向该溶液中加入足量HCl,无现象,再加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO![]()
D.向该溶液中加入BaCl2溶液,产生白色沉淀,再加入HCl沉淀不溶解,说明该溶液中一定有SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
|
|
|
|
A.实验室制取溴苯 | B.实验室制取乙酸乙酯 | C.石油分馏 | D.实验室制取硝基苯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com