
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
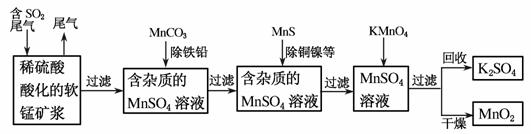
请回答下列问题:
(1)上述流程脱硫实现了________(填选项字母)。
A.废弃物的综合利用 B.白色污染的减少
C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是
__________________________________________________________。
(3)已知:25 ℃、101 kPa时,
Mn(s)+O2(g)===MnO2(s)
ΔH=-520 kJ/mol
S(s)+O2(g)===SO2(g) ΔH=-297 kJ/mol
Mn(s)+S(s)+2O2(g)===MnSO4(s)
ΔH=-1 065 kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是____________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是_________________________________。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是_____________________________________。
(6)假设脱除的SO2只与软锰矿浆中MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2________kg。
解析 (1)该流程中,能将含硫尾气吸收,充分利用了废弃物,同时减少了大气中能形成酸雨的SO2,故A、C项符合,该过程对白色污染无影响。
(2)软锰矿用稀硫酸溶解且通入SO2后,溶液中含有反应生成的金属阳离子,其中MnO2被SO2还原为Mn2+,其他金属变成相应的金属阳离子Fe3+、Al3+、Cu2+、Ni2+,故加入MnCO3后发生反应MnCO3+2H+===Mn2++CO2↑+H2O而消耗了溶液中的H+,使溶液的pH升高,使得Al3+和Fe3+水解生成氢氧化物沉淀而除去。
(3)将给定的三个热化学方程式依次编为①②③,将三个方程式按照③-①-②处理后可得热化学方程式
MnO2(s)+SO2(g)===MnSO4(s) ΔH=-248 kJ/mol。
(4)用惰性电极电解MnSO4溶液制取MnO2时,在阳极上Mn2+失电子后生成MnO2,根据电荷守恒和原子守恒可得电极反应式Mn2++2H2O-2e-===MnO2+4H+。
(5)碱性锌锰干电池在放电时,正极上MnO2得电子生成碱式氧化锰MnO(OH),根据电荷守恒和原子守恒可得电极反应式MnO2+H2O+e-===MnO(OH)+OH-。
(6)根据方程式MnO2(s)+SO2(g)===MgSO4(s)可知n(SO2)=n(MnO2),又根据:2KMnO4+3MnSO4+2H2O===5MnO2+2H2SO4+K2SO4,可知由硫酸锰生成的MnO2的物质的量为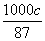 ×
×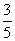 mol,则引入的锰元素相当于MnO2的质量为:
mol,则引入的锰元素相当于MnO2的质量为:
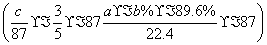 kg=
kg= kg。
kg。
答案 (1)AC
(2)消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀
(3)MnO2(s)+SO2(g)===MnSO4(s) ΔH=-248 kJ/mol
(4)Mn2++2H2O-2e-===MnO2+4H+
(5)MnO2+H2O+e-===MnO(OH)+OH-
(6)


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
工业合成氨与制备硝酸一般可连续生产,流程如图所示:
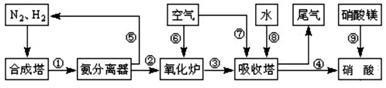
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
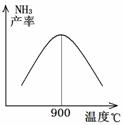
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图所示。温度高于900℃时,NH3产率下降的原因是
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是( )
A.将铁粉加入稀硫酸中:2Fe+6H+===2Fe3++3H2↑
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+===3Fe3++4H2O
C.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO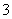 ===Fe3++2H2O+NO↑
===Fe3++2H2O+NO↑
D.将铜屑加入Fe3+溶液中:2Fe3++Cu===2Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
当反应2SO2+O22SO3达到平衡后,通入18O2,再次达到平衡时18O存在于
( )
A.SO3、O2中 B.SO2、SO3中
C.SO2、O2中 D.SO2、SO3和O2中
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在一个1 L的密闭容器中放入4 mol N2O5气体后会发生如下两种反应:①N2O5(g)N2O3(g)+O2(g);②N2O3(g)N2O(g)+O2(g)。在某温度下达到平衡后c(O2)=4.4 mol·L-1,c(N2O3)=1.6 mol·L-1。求反应中N2O5的分解率。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关有机化合物的组成、性质的说法,正确的是( )
A.天然气、液化石油气的成分相同
B.葡萄糖、淀粉和乙酸乙酯在一定条件下都能发生水解反应
C.淀粉、蛋白质均属于高分子化合物,而油脂不属于高分子化合物
D.石油的 裂解是化学变化,而石油的分馏和煤的干馏都是物理变化
裂解是化学变化,而石油的分馏和煤的干馏都是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
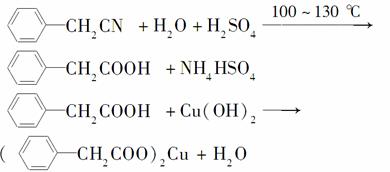
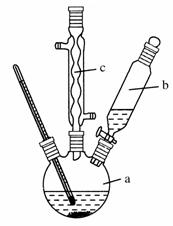
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是__________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温到130 ℃继续反应。在装置中,仪器b的作用是__________;仪器c的名称是__________,其作用是_______________________________。
反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是________。下列仪器中可用于分离苯乙酸粗品的是________(填选项字母)。
A.分液漏斗 B.漏斗
C.烧杯 D.直形冷凝管
E.玻璃棒
(3)提纯粗苯乙酸的方法是________,最终得到44 g纯品,则苯 乙酸的产率是________。
乙酸的产率是________。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是______________。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙 酸铜晶体,混合溶剂中乙醇的作用是
酸铜晶体,混合溶剂中乙醇的作用是
___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
要提纯下列物质(括号内物质为杂质),实验操作最合理的是( )
A.Cl2(SO2):通入盛有品红溶液的洗气瓶
B.己烷(己烯):加入足量的溴水,充分振荡,静置分层后分离
C.硫酸铁溶液(硫酸亚铁):通入足量氯气,充分反应后加热,使多余氯气逸出
D.Mg(OH)2[Ca(OH)2]:放入水中调成浆状后,加入足量MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com