
(11分)研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题。
(1)CO可用于合成甲醇。在压强为0.1Mpa条件下,在体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图: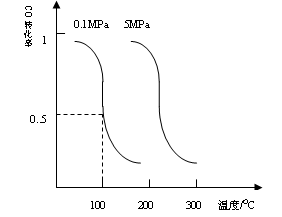
(i)该反应属于_____________反应:(填“吸热”或“放热”)。
(ii)100℃时,该反应的平衡常数:K=_____________;(用a、b的代数式表示)。
若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是:_________________填序号)
| A.该反应使用催化剂意义不大; |
| B.该反应发生将在很短时间内完成; |
| C.该反应达到平衡时至少有一种反应物百分含量很小; |
| D.该反应一定是放热反应; |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 (2012?闵行区二模)研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢课题.CO可用于合成甲醇.在压强为0.1MPa条件下,在体积为b L的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g),平衡时CO的转化率与温度、压强的关系如图:
(2012?闵行区二模)研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢课题.CO可用于合成甲醇.在压强为0.1MPa条件下,在体积为b L的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g),平衡时CO的转化率与温度、压强的关系如图:查看答案和解析>>
科目:高中化学 来源:枣庄一模 题型:问答题
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(08枣庄调研)燃料和能源是化学知识与社会生活联系极为密切的内容。我们要关注矿物能源的合理利用,积极研究、开发新能源。
(1)新能源应该具有原状料易得、燃烧时产生的热量多且不会污染环境特点。在煤炭、石油、煤气、氢气中,前途广阔的能源是 。
(2)近年来,我国煤矿事故大多是由于瓦斯暴炸所致。瓦斯中含有甲烷和一氧化碳等气体,当矿井中瓦斯浓度达到一定范围时遇明火即燃烧爆炸。为避免灾难的发生应采取的切实可行的措施有 (填序号)
①加强安全管理,杜绝明火源 ②降低瓦斯气体的着火点
③提高通风能力 ④将矿井中的氧气抽去
(3)为了提高煤的热效应,同时减少燃烧时的环境污染,常将煤转化为水煤气,这是将煤转化为洁净燃料的方法之一。水煤气的主要成分是一氧化碳的氢气,它是由煤炭和水蒸气反应制得,已知C(石墨)、CO、H2燃烧的热化学方程式为:
C(s,石墨)+O2(g) CO2(g)△H1=-393.5kJ?mol-1
H2(g)+![]() O2(g)
O2(g) H2O(g)△H2=-241.8kJ?mol-1
CO(g)+O![]() 2(g)
2(g) CO2(g)△H3=-283.0kJ?mol-1
H2(g)+![]() O2(g)
O2(g) H2O(1)△H4=-285.8kJ?mol-1
请回答下列问题:
①根据上述提供的热化学方程式计算,36g水由液态变成气态的热量变化是 。
②写出C(s,石墨)与水蒸气反应的热化学方程式 。
③丙烷是液化石油气的主要成分之一,丙烷燃烧的热化学方程式为:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(g)△H=-2220.0kJ?mol-1
相同物质的量的丙烷和一氧化碳完全燃烧生成气态产物时,产生的热量之比为___,相同质量的氢气和丙烷完全燃烧生成气态产物时,产生的热量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
研究和开发CO2 和CO的创新利用是环境保护和资源利用
的双赢的课题。
I.CO可用于合成甲醇。在压强为0.1Mpa条件下,在体积为bL的密
闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇;
![]() 平衡时CO的转化率与温度,压强的关系如下图:
平衡时CO的转化率与温度,压强的关系如下图:
 (1)100℃时,该反应的平衡常数:
(1)100℃时,该反应的平衡常数:
K= ;(用a、b的代数式表
示)。若一个可逆反应的平衡常数K值
很 大,对此反应的说法正确的是:
(填序号)
A.该反应使用催化剂意义不大;
B.该反应发生将在很短时间内完成;
C. 该反应达到平衡时至少有一种反应物
百分含量很小;
D.反应物的转化率一定高:
(2)在温度和容积不变的情况下,再向平衡体系中充入amolCO,2amolH2,达到平衡时
CO转化率 (填“增大”,“不变”或“减小”,下同)平衡常数: 。
(3)在某温度下,向一容积不变的密闭容器中充入2.5molCO,7.5molH2,反应生成CH3OH
(g),达到平衡时,CO转化率为90%,此时容器内压强为开始时的压强 倍。
11.某温度条件下,若将CO2(g)和H2(g)以体积比1:4混合,在适当压强和催化剂
作用下可制得甲烷,己知:
![]()
则![]() 和
和![]() 反应生成液态水的热化学方程式为:
反应生成液态水的热化学方程式为:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com