
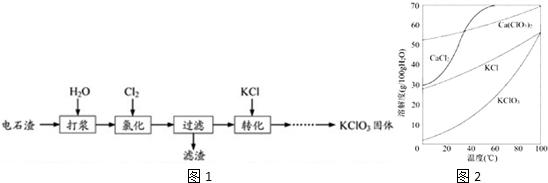
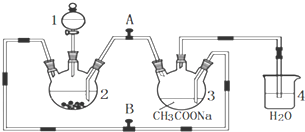
分析 电石渣含有Ca(OH)2,加入水打浆,通入氯气,可生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2,过滤后在滤液中加入KCl转化生成KClO3,经蒸发浓缩、冷却结晶可得晶体KClO3,
(1)①氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水;
②提高Cl2转化为Ca(ClO3)2的转化率,可使氯气和氢氧化钙充分接触;
(2)①发生6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O,生成的Ca(ClO3)2溶于水,CaCO3不溶于水,Ca(OH)2微溶;
②氯化过程中Cl2与氢氧化钙反应部分生成Ca(ClO)2和CaCl2;
(3)经蒸发浓缩、冷却结晶可得晶体KClO3.
解答 解:电石渣含有Ca(OH)2,加入水打浆,通入氯气,可生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2,过滤后在滤液中加入KCl转化生成KClO3,经蒸发浓缩、冷却结晶可得晶体KClO3,
(1)②氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②提高Cl2转化为Ca(ClO3)2的转化率,可使氯气和氢氧化钙充分接触,可适当减缓通入Cl2速率、充分搅拌浆料,因氢氧化钙微溶于水,加水溶解的做法不可取,因浓度过低,对后续实验不利,
故答案为:AB;
(2)①发生6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O,生成的Ca(ClO3)2溶于水,CaCO3不溶于水,Ca(OH)2微溶,则滤渣中含有CaCO3、Ca(OH)2,
故答案为:CaCO3、Ca(OH)2;
②氯化过程中Cl2与氢氧化钙反应部分生成Ca(ClO)2和CaCl2,则n[Ca(ClO3)2]:n[CaCl2]<1:5,故答案为:<;
(3)该溶液中尽可能多地析出KClO3固体,应经蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶.
点评 本题考查物质的制备,为高考常见题型和高频考点,侧重于学生的分析、实验能力的考查,解答本题注意把握物质的性质以及题给信息,把握反应的流程,同时要具有扎实的实验基础知识,难度不大.


科目:高中化学 来源: 题型:解答题
 .
. .
. (或
(或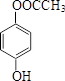 、
、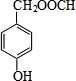 ).
).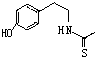 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为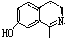 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④ | C. | ②④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
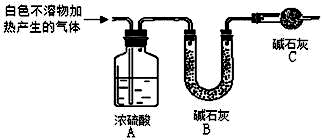
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅰ | 取一小段镁条,用砂纸擦去表面氧化膜,将其放入足量的滴有酚酞的饱和NaHCO3溶液中,充分反应后过滤 | 产生较多气泡和白色不溶物,溶液有浅红色变成红色 | |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧,火焰呈淡蓝色 | 气体成分为 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中白色不溶物滤出、洗涤,取少量加入足量稀盐酸 | ②产生气泡沉淀全部溶解 | 白色不溶物中含有 MgCO3 |
| 实验Ⅳ | ③CaCl2或BaCl2 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
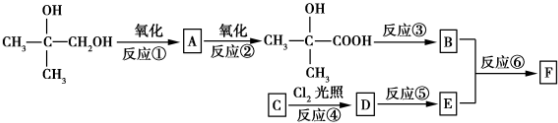
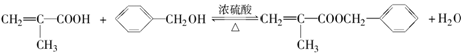 .
.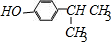 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮
(1)有两种气体单质Am和Bn.已知7.2g Am和6.3g Bn所含的原子个数相同,分子个数之比却为2:3.又知A原子中L电子层含电子数是K电子层的3倍.通过计算回答:写出B的元素名称氮查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com