
| J | ||||
| R |
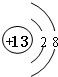 ��Ԫ��T���ڱ���λ�ڵڢ�A�壮
��Ԫ��T���ڱ���λ�ڵڢ�A�壮���� J��L��M��R��T��ԭ��������������Ķ���������Ԫ�أ�M�ǵؿ��к������Ľ���Ԫ�أ���MΪAl����֪R��T���õ������ڣ���Ԫ��J��R�����ڱ��е����λ�ã���֪J���ڵڶ����ڣ���JԪ��������ϼ۵ľ���ֵ����ԭ��������������ȣ���J����������Ϊ4����JΪCԪ�أ���RΪSԪ�ء�TΪCl��L��ԭ����������̼����֮�䣬��LΪNԪ�أ�
��� �⣺J��L��M��R��T��ԭ��������������Ķ���������Ԫ�أ�M�ǵؿ��к������Ľ���Ԫ�أ���MΪAl����֪R��T���õ������ڣ���Ԫ��J��R�����ڱ��е����λ�ã���֪J���ڵڶ����ڣ���JԪ��������ϼ۵ľ���ֵ����ԭ��������������ȣ���J����������Ϊ4����JΪCԪ�أ���RΪSԪ�ء�TΪCl��L��ԭ����������̼����֮�䣬��LΪNԪ�أ�
��1��MΪAl��������Ϊ13�������ӽṹʾ��ͼΪ ��TΪCl��λ�ڵڢ�A�壬�ʴ�Ϊ��
��TΪCl��λ�ڵڢ�A�壬�ʴ�Ϊ�� ����A��
����A��
��2��J������ɵĻ����������4��ԭ�ӣ�Ϊ��Ȳ���ṹʽΪH-C��C-H���ʴ�Ϊ��H-C��C-H��
��3��M��T�γɵĻ������ڳ�ʪ�Ŀ�����ð��ɫ����������ˮ�ⷴӦ���÷�Ӧ����ʽΪ��AlCl3+3H2O=Al��OH��3+3HCl����
�ʴ�Ϊ��AlCl3+3H2O=Al��OH��3+3HCl����
��4����LΪNԪ�أ�����⻯��Ϊ��������������ⷴӦ���ɵ�����ˮ����Ӧ����ʽΪ��2NH3•H2O+3H2O2=N2+8H2O��
�ʴ�Ϊ��2NH3•H2O+3H2O2=N2+8H2O��
�ڰ�����������KOH ��Һ����ԭ��أ���������������Ӧ��������������ӦΪ��2NH3-6e-+6OH-�TN2+6H2O��
�ʴ�Ϊ��2NH3-6e-+6OH-�TN2+6H2O��
��5��0.2mol CS2 ��O2����ȫȼ�գ�����������̬������Ϊ������̼�Ͷ�������298Kʱ�ų�����215kJ����1mol����̼��ȫȼ�������ȶ�������ų�������Ϊ215kJ��$\frac{1mol}{0.2mol}$=1075kJ�����Ȼ�ѧ��Ӧ����ʽΪ��CS2��l��+3O2��g��=CO2��g��+2SO2��g����H=-1075KJ/mol��
�ʴ�Ϊ��CS2��l��+3O2��g��=CO2��g��+2SO2��g����H=-1075KJ/mol��
���� ���⿼��ṹ����λ�ù�ϵӦ�ã��漰Ԫ�����ڱ������û�ѧ�������ˮ�⡢ԭ��ء��Ȼ�ѧ����ʽ��д�ȣ���Ŀ��Ϊ�ۺϣ���Ҫѧ���߱���ʵ��֪ʶ��������Ϣ������֪ʶ���������������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
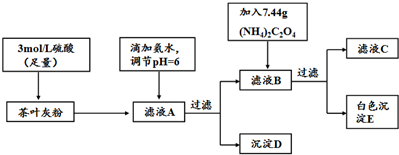
| ���� | Ca2+ | Fe3+ |
| ��ȫ����ʱ��pH | 13 | 3.7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ���̿� | ��п�� |
| MnO2Լ70%��SiO2Լ20%��Al2O3Լ4%������Ϊˮ�� | ZnSԼ80%��FeS��CuS��SiO2��Լ7%������Ϊˮ�� |
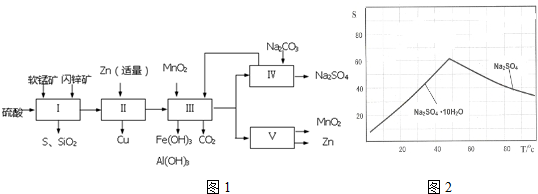
| �������� | Fe��OH��3 | Al��OH��3 | Fe��OH��2 |
| ��ʼ����pH | 1.5 | 3.3 | 7.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϩ������ˮ���Ĵ���� | |
| B�� | �������������ʳƷ��Ư�� | |
| C�� | �������������ظ���������˾���Ƿ�Ƽ� | |
| D�� | ��ͭ��ͭп�Ͻ�������ͭ��ײ���ͭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
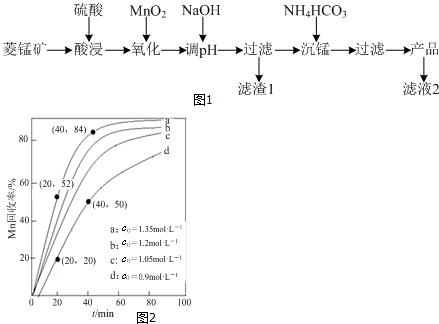
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ba2+ HCO3- K+ Cl- | B�� | CO32- OH- Na+ NO3- | ||
| C�� | OH- Na+ SO42- CO32- | D�� | Cu2+ Cl- Na+ NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4Fe��SO4��2�������NaOH��Һ�У���NH4++Fe3++4OH-�TNH3•H2O+Fe��OH��3�� | |
| B�� | ����������Һ��ͨ������Ķ�������ClO-+SO2+H2O�THSO3-+HClO | |
| C�� | Ba��OH��2��Һ��ϡ���ᷴӦ��Ba2++OH-+H++SO42-�TBaSO4��+H2O | |
| D�� | �����ʯ��ˮ�м��������NaHCO3��Һ��Ca2++OH-+HCO3-�TCaCO3��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com