
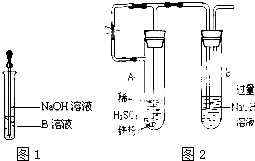
 某同学利用右图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.
某同学利用右图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质.分析 (1)铁粉与水蒸气反应产物为四氧化三铁和氢气;
(2)四氧化三铁中有+2价的铁和+3价的铁,KSCN溶液溶液变红色,说明有三价铁离子;还有可能有过量的铁;若溶液未变红,过量的铁,可能将三价铁离子全部转化成二价铁离子;
(3)铁单质能将三价铁离子还原成二价铁离子;
(4)滴入NaOH溶液时,生成的白色沉淀Fe(OH)2迅速变成灰绿色,最后变成红褐色Fe(OH)3;
(5)铁单质能将三价铁离子还原成二价铁离子,Fe2+具有还原性,Fe2+易被空气中的氧气氧化而变质;
(6)为了获得持久白色的Fe(OH)2沉淀,必须通过蒸馏水煮沸、排除装置中的空气等办法使得氢氧化亚铁生成在一个无氧的环境中.
解答 解:(1)铁在高温下与水反应,生成四氧化三铁和氢气,反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4 +4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4 +4H2;
(2)铁和水蒸气反应,产物为四氧化三铁和氢气,反应后试管中固体物质一定有Fe3O4,还可能有没反应完全的铁粉,取少许其中的固体物质溶于稀盐酸后,滴加KSCN溶液,若溶液变红色则说明试管中固体物质的成分一定含Fe3O4;若溶液未变红色,是因为固体物质中既含Fe3O4又含Fe,溶于盐酸后发生反应Fe+2Fe3+═2Fe2+,导致Fe3+被还原,溶液才未变红色,
故答案为:A;C;
(3)结果溶液未变红色,原因是加入稀盐酸时发生反应:2FeCl3+Fe═3FeCl2,
故答案为:2FeCl3+Fe═3FeCl2;
(4)溶液B中含Fe2+,滴入NaOH溶液后,发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,生成Fe(OH)2是白色沉淀.沉淀迅速变成灰绿色,最后变成红褐色,是典型的Fe(OH)2被氧化为Fe(OH)3的现象,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)一段时间后,两同学发现(3)中未变红的溶液变成红色,是因为空气中的氧气将Fe2+氧化为了Fe3+的原因,在此反应中Fe2+被氧化,体现还原性.为了防止Fe2+被氧化,加铁粉最好,发生反应:Fe+2FeCl3=3FeCl2,不引入新杂质,
故答案为:FeCl2易被空气中的氧气氧化为FeCl3而变质;铁粉;
(6)用煮沸的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应;反应开始时,要打开止水夹,利用铁粉和稀硫酸反应产生的氢气排出试管A、B中的空气,使整个装置不含氧气.在对B试管的出气管排出的氢气验纯之后,关闭止水夹,由于产生的氢气无法排出,试管A中的压强将增大,最终将A试管中生成的FeSO4溶液压入NaOH溶液中,故Fe(OH)2在B试管生成,
故答案为:用产生的氢气排尽试管A、B中的空气;B.
点评 本题考查铁及其化合物的性质实验,题目难度中等,注意三价铁离子与二价铁离子的转化,Fe3+和Fe2+ 的检验、Fe2+的还原性以及Fe(OH)2的制备.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
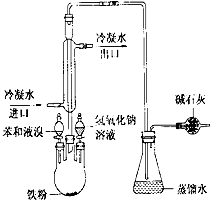 如图是实验室制取溴苯的装置图
如图是实验室制取溴苯的装置图查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
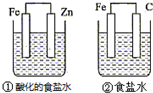
| A. | ①和②中铁的腐蚀均被加速 | |
| B. | ①和②中负极反应均是Fe-2e-═Fe2+ | |
| C. | ②中碳棒上反应是O2+2H2O+4e-═4OH- | |
| D. | ①装置中溶液pH会升高,②装置中溶液碱性增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com