
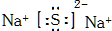 ,故答案为:
,故答案为: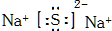 ;
;
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B、向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
| C、实验室常用排饱和食盐水的方法收集氯气 |
| D、棕红色NO2加压后颜色先变深后变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,30 g的2-丙醇中含有羟基的数目为0.5 NA |
| B、15g C2H6含C-H键数目为3NA |
| C、28g乙烯与丙烯的混合气体,含碳原子总数为2NA |
D、7.8g 中含有的碳碳双键数目为0.3NA 中含有的碳碳双键数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 请按以下要求,回答下列相应问题:
请按以下要求,回答下列相应问题:| 序号 | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶解于酸的时间/s |
| 1 | 2 | 薄片 | 5 | 400 |
| 2 | 2 | 颗粒 | 5 | 500 |
| 3 | 2 | 薄片 | 15 | 200 |
| 4 | 2 | 薄片 | 25 | 100 |
| 5 | 2 | 薄片 | 35 | 50 |
| 6 | 2 | 颗粒 | 15 | t1 |
| 7 | 2 | 粉末 | 15 | t2 |
| T/K | 298 | 398 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
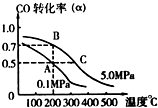 在10L密闭容器中充有10mol CO 与20mol H2,在催化剂作用下反应生成甲醇:
在10L密闭容器中充有10mol CO 与20mol H2,在催化剂作用下反应生成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:
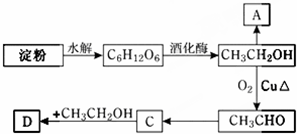
查看答案和解析>>
科目:高中化学 来源: 题型:
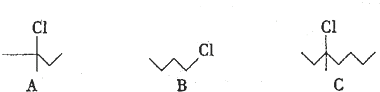
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com