
| A. | O2是还原产物 | |
| B. | O2F2中氧分子与氟分子比例为1:l | |
| C. | 每生成2.24LHF,转移0.4mol电子 | |
| D. | 氧化剂与还原剂的物质的量之比为l:4 |
分析 反应H2S+O2F2→SF6+HF+O2中,S元素化合价由-2价升高到+6价为还原剂,被氧化,O元素由+1价降低到0价为氧化剂,被还原,以此解答该题.
解答 解:A.O元素由+1价降低到0价,化合价降低,获得电子,所以氧气是还原产物,故A正确;
B.在反应中,O2F2中的O元素化合价为+1,F元素化合价为-1,不存在氧分子与氟分子,故B错误;
C.外界条件不明确,不能确定HF的物质的量,所以不能确定转移电子的数目,故C错误;
D.反应H2S+O2F2→SF6+HF+O2中,S元素化合价由-2价升高到+6价为还原剂,被氧化,O元素由+1价降低到0价为氧化剂,被还原,根据得失电子守恒,可知氧化剂与还原剂的物质的量之比为4:1,故D错误.
故选A.
点评 本题考查氧化还原反应的计算,为高频考点和常见题型,侧重于学生的分析、计算能力的考查,答题注意把握元素化合价的变化,为解答该题的关键,易错点为C,注意因条件未知,不能确定HF的物质的量,题目难度不大.


科目:高中化学 来源: 题型:推断题
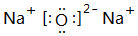 、
、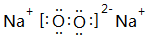 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L盐酸和0.1mol/L醋酸分别与0.2mol/L氢氧化钠溶液反应的速率相同 | |
| B. | 0.1mol/L盐酸和0.1mol/L硝酸分别与大小相同的大理石反应的速率相同 | |
| C. | 铝和铁分别与0.1mol/L硫酸的反应速率相同 | |
| D. | 大理石块与大理石粉末分别与0.1mol/L盐酸反应的速率相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制CuSO4时先将Cu氧化成CuO后再与稀硫酸反应 | |
| B. | 采用银作催化剂,乙烯和氧气制取环氧乙烷,原子利用率100% | |
| C. | 用乙醇代替汽油作汽车燃料 | |
| D. | 用稀硝酸和铜制取Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有质子的微粒一定有中子 | |
| B. | 通常所说的氢元素是指${\;}_{1}^{1}$H | |
| C. | 16O中的“16”表示氧元素的近似相对原子质量 | |
| D. | 根据反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O得到的Cl2,其相对分子质量为73.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 价层电子对互斥理论将分子分成两类:中心原子有孤电子对的和无孤电子对的 | |
| B. | 价层电子对互斥理论既适用于单质分子,也适用于化合物分子 | |
| C. | sp3杂化轨道是由一个原子中能量相近的s轨道和p轨道通过杂化形成的一组能量相近的新轨道 | |
| D. | AB2型共价化合物的中心原子A采取的杂化方式可能不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雪白、漂亮的“白木耳”,可能是在用硫黄熏制的过程中产生的SO2所致,食用对人体的肝、肾脏等有损害,并有致癌作用 | |
| B. | 可溶性硅酸盐与其他酸反应制得硅酸,生成的硅酸逐渐聚合而形成胶体溶液为硅胶,硅胶可用作食品干燥剂和催化剂载体 | |
| C. | 胶体化学的应用很广,是制备纳米材料的有效方法之一,某材料的直径在1~100nm之间,该材料均匀分散到某液体分散剂中,该分散系可产生丁达尔效应 | |
| D. | 在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂,在工业上硫酸亚铁还是生产铁系列净水剂和颜料氧化铁红(主要成分为Fe2O3)的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH<5.6降水通常称为酸雨;CO2的大量排放能破坏臭氧层,形成“臭氧空洞” | |
| B. | 总质量一定时,乙酸和葡萄糖无论以何种比例混合,完全燃烧消耗氧气的量相等 | |
| C. | 燃煤时加入适量石灰石,可减少废气中SO2的量 | |
| D. | 有机高分子化合物称为聚合物或高聚物,是因为他们大部分是由小分子通过聚合反应制得的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com