
���� ��1�������ķ��ȷ�Ӧ�У����е�����ȼ�ա����н����������ˮ�������кͷ�Ӧ������������Ϸ�Ӧ�����ȷ�Ӧ��
���������ȷ�Ӧ�У��������ֽⷴӦ������Ļ��Ϸ�Ӧ����C��CO2������ҵ��ˮú����̼��һ����̼����������ԭ���������ijЩ���ֽ⣨����κ�ǿ���
��2�����ݽ����Ļ������ж������������ݵ缫�Ϸ�����Ӧ������ȷ���缫��Ӧʽ�������缫��Ӧʽ��Ӽ����ܷ�Ӧ����ʽ��
��3����пƬ��ͭƬ���Ӻ����ϡ������Һ�У�������ԭ��أ�пΪ�������缫��ӦΪ��Zn-2e-=Zn2+��ͭΪ�������缫��ӦΪ2H++2e-=H2������������ת�Ƶ�����Ŀ��ȼ��㣮
��� �⣺��1��������ʯ��ʯ�������ȷ�Ӧ�����е�ȼ�ա�ըҩ��ը������к͡�����������ˮ�Լ�ʳ��ĸ��ܾ�Ϊ���ȷ�Ӧ���ʴ�Ϊ���٣�
��2�����ݽ����Ļ������жϣ�ͭ��������ͭʧȥ���ӱ�����ӽ�����Һ������������Ӧ��Cu-2 e-=Cu2+�����������������ӵõ������������ʣ�������ԭ��Ӧ��2Ag++2 e-=2Ag�������缫��Ӧʽ��Ӽ����ܷ�Ӧ����ʽ��Cu+2Ag+=2Ag+Cu2+���ʴ�Ϊ������ Cu-2e-=Cu2+��
��3���⣺��пƬ��ͭƬ���Ӻ����ϡ������Һ�У�������ԭ��أ�
пΪ�������缫��ӦΪ��Zn-2e-=Zn2+��
ͭΪ�������缫��ӦΪ2H++2e-=H2����
пƬ������������3.25�ˣ������ʵ���Ϊ$\frac{3.25g}{65g/mol}$=0.05mol��
ת�Ƶĵ��ӵ����ʵ���Ϊn��e-��=2n��Zn��=2n��H2��=2��0.05mol=0.1mol��
��V��H2��=0.05mol��22.4L/mol=1.12L��
�ʴ�Ϊ��1.12��0.1��
���� ������Ҫ����������ȷ�Ӧ����ȷ�Ӧ��ԭ��صĹ���ԭ������Ŀ�ѶȲ���ע�������缫��Ӧת�Ƶĵ�����Ŀ��ȣ�


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
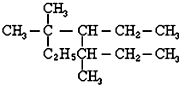 ��������3��3��5-����-4-�һ����飮
��������3��3��5-����-4-�һ����飮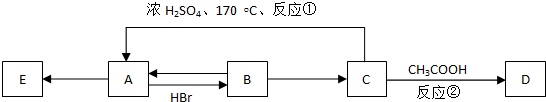
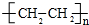 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������ÿ����ԭ�Ӷ��ﵽ��8�����ȶ��ṹ | |
| B�� | 1 mol H2��������2 mol H�������� | |
| C�� | 1 mol H2����2 mol HҪ�ų�437.6 kJ���� | |
| D�� | ��ԭ�Ӳ�������ӻ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C14H30 | B�� | C15H32 | C�� | C16H34 | D�� | C17H36 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������Ƶ���ʽ�� | |
| B�� | ������35��������45����ԭ�ӣ�${\;}_{35}^{80}$Br | |
| C�� | �����ӽṹʾ��ͼ�� | |
| D�� | HClO�Ľṹʽ��H-Cl-O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����� | ���� | ���� |
| A | ��0.1mol•L-1MgSO4��Һ����NaOH��Һ�������г����������ٵμ�0.1mol•L-1CuSO4��Һ | ���а�ɫ�������ɺ��Ϊ��ɫ���� | Cu��OH��2��Ksp��Mg��OH��2��С |
| B | �ýྻ��˿պȡ��Һ������ɫ��Ӧ | ����ʻ�ɫ | ԭ��Һ����Na+����K+ |
| C | ��ʢNa2SiO3 ��Һ���Թ��еμ�1�η�̪��Ȼ����μ���ϡ��������ɫ��ȥ | 2min���Թ���������� | �ǽ����ԣ�Cl��Si |
| D | �������м���Ũ���� | ���DZ�����ɶ�ĺ���״̼ | Ũ���������ˮ�Ժ�ǿ������ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| X | Y | ���� | װ�� | |
| A | ��ˮ | ʯ�� | ��Һ�ȱ�����ɫ | 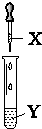 |
| B | ��ˮ | AgNO3��Һ | �Ȳ������������ܽ� | |
| C | NaOH��Һ | AlCl3��Һ | ������ɫ�����Ҳ���ʧ | |
| D | ˫��ˮ | ���Ե���KI��Һ | ��Һ����ɫ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����̼���̵�Ŀ���dz�ȥFe3+ | |
| B�� | ������pH=4ʱ��Fe3+�ѳ��� | |
| C�� | Cu2+��aq��+MnS��s��=CuS��s��+Mn2+��aq����K=2.73��10-23 | |
| D�� | Mn2��OH��2CO3��Mn��OH��2���������MnCO3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com