
【题目】在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=﹣akJmol﹣1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
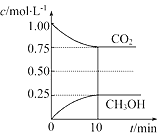
(1)能说明该反应已达平衡状态的是________(填编号)。
A.单位时间内每消耗1.2mol H2,同时生成0.4mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
(2)若要使K=1,则改变的条件可以是________(填选项)。
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加入催化剂。
【答案】BC D
【解析】
(1)①平衡状态可以根据两个方两去判断,一、是看正逆反应速是否相等,二是各组分的浓度是否随时间的改变而改变;也可以抓住变量不变来解分析;
(2)先计算该温度下此反应的平衡常数,根据平衡常数只与温度有关,分析若使该反应K=l需要改变的条件。
(1)①A.单位时间内每消耗1.2mol H2,同时生成0.4mol H2O,不能反映正逆反应速率之间的关系,故不选A错误;
B.反应过程中CO2的体积分数是个变化的量,现在混合气体CO2的体积分数保持不变,说明已经平衡了,故选B;
C.根据 ,反应过程中,混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故选C;
,反应过程中,混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故选C;
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明各自的浓度不再随时间的变化而变化,故不选D。
(2) 通入2mol CO2和3mol H2,根据图示,

![]() 0.20,
0.20,
平衡常数是温度的函数,只有通过改变温度来改变平衡常数,正反应量放热反应,降低温度,K值变大,若要使K=1,则改变的条件可以是降温,选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
①Fe(SCN)3溶液中加入固体KSCN后颜色变深②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 ③实验室常用排饱和食盐水的方法收集氯气 ④棕红色NO2加压后颜色先变深后变浅 ⑤加入催化剂有利于合成氨的反应 ⑥由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深 ⑦500℃时比室温更有利于合成氨的反应 ⑧将混合气体中的氨液化有利于合成氨反应
A. ①②⑥⑧B. ①③⑤⑦C. ②⑤⑥⑦D. ②③⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是![]()
![]()
A.Na2S溶液中S2-的水解:![]()
B.用石墨作电极电解NaCl溶液:![]()
C.碱性氢氧燃料电池负极反应为: H2 +2OH-2e- = 2H2O
D.钢铁发生吸氧腐蚀,负极反应为:Fe-3e- = Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)作为著名的铁电和压电材料,因其优异电性能和低污染性受到人们重视,也是目前制备无铅压电陶瓷的重要候选材料。某工厂以重晶石(主要含BaSO4)为原料,生产钛酸钡的工艺流程如图:

回答下列问题:
(1)酸浸时将BaCO3研成粉末并适当增大盐酸浓度,是为了___;常温下,TiCl4为液体且极易水解,配制一定浓度的TiCl4溶液的方法是__。
(2)用Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K=__(填写计算结果);若不考虑CO32-的水解,要使2.33gBaSO4恰好完全转化为BaCO3,则至少需要浓度为1.0mol·L-1Na2CO3溶液__mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)
(3)流程中“滤液"的主要成分为__;隔绝空气煅烧草酸氧钛钡晶体得到钛酸钡粉体和混合气态产物,试写出反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+,O2,NO3-等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )

A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去amolCl时ne=amol
C. ④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D. 增大单位体积水体中小粒径ZVI的投入量,可使nt增大
查看答案和解析>>
科目:高中化学 来源: 题型:
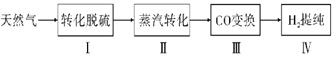
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如图。
请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T·F菌作用下,酸性环境中脱硫过程示意图如下。
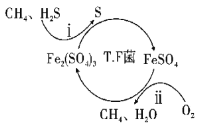
(1)过程i的离子反应方程式为__。
(2)已知:
①Fe3+在pH=1.9时开始沉淀pH=3.2时沉淀完全。
②30℃时,在T·F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
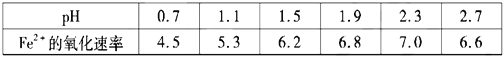
下列说法正确的是___
A.在转化脱硫中,最佳的pH范围是1.5<pH<1.9
B.在转化脱硫中需要不断补充Fe2(SO4)3
C.在转化脱硫中是O2间接地把H2S氧化为S
D.在转化脱硫中CH4作为还原剂被氧化
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。

(3)①该过程的热化学方程式是__。
②比较压强p1和p2的大小关系:p1__p2(选填“<”、“>”或“=”)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.提纯:将CO2和H2分离得到H2的过程示意图如图。
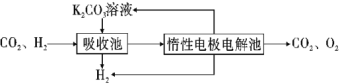
(4)吸收池中发生反应的离子方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
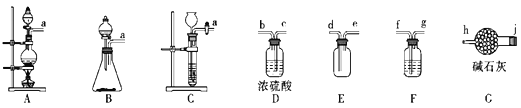
【题目】亚硝酰氯((ClNO)是合成有机物的重要中间体,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
已知:1).亚硝酰氯沸点为-5.5℃,易水解,C1NO+H2O=HNO2+HCl;
2).AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3+HNO2。
(1)制备Cl2的发生装置可以选用__(填字母代号)装置,发生反应的离子方程式为__。
(2)欲收集一瓶干燥纯净的氯气,选择合适的装置,其连接顺序为a→__(按气流方向,用小写字母表示)。
(3)实验室可用图示装置制备亚硝酰氯:
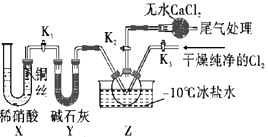
本实验利用X装置制备NO最主要的优点为__,装置中无水CaCl2的作用是__。
(4)通过以下实验测定C1NO样品的纯度。取Z中所得液体mg溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是__,亚硝酰氯(ClNO)的质量分数为__。(已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家首次实现了膦催化的(3+2)环加成反应,并依据该反应,发展了一条合成中草药活性成分茅苍术醇的有效路线。
已知(3+2)环加成反应:CH3C![]() C-E1+E2-CH=CH2
C-E1+E2-CH=CH2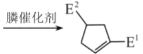 (E1、E2可以是-COR或-COOR)
(E1、E2可以是-COR或-COOR)
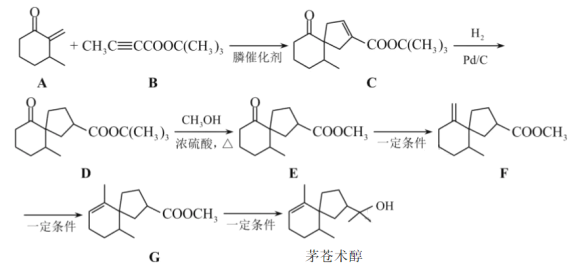
回答下列问题:
(1)茅苍术醇的分子式为__,所含官能团名称为__,分子中手性碳原子(连有四个不同的原子或原子团)的数目为__。
(2)化合物B满足以下条件的同分异构体(不考虑手性异构)数目为__。
①分子中含有碳碳三键和乙酯基(-COOCH2CH3)
②分子中有连续四个碳原子在一条直线上
写出其中一种碳碳三键和乙酯基直接相连的同分异构体的结构简式__。
(3)C→D的反应类型为__。
(4)D→E的化学方程式为__。
(5)参考以上合成路线及条件,选择两种链状不饱和酯,通过两步反应合成化合物M,在方框中写出路线流程图___(其他试剂任选)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种信息材料的添加剂,在相同条件下,A蒸气是同体积氢气质量的88.25倍。在A分子中各元素质量分数分别为w(C)=54.4%,w(H)=7.4%,w(O)=18.1%,w(Cl)=20.1%,A在不同条件下可发生如图所示的一系列变化。
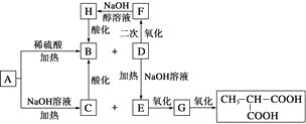
请回答下列问题:
(1)A的分子式为__________。
(2)D分子含有的官能团是________________。
(3)上述转换关系的化学方程式中,属于水解反应的有________个(填数字)。
(4)写出化学方程式:
①A和稀硫酸共热:____________________________________________________;
②E氧化成G:__________________________________________________;
③F与氢氧化钠醇溶液共热:__________________________________________。
(5)与B互为同分异构体的且属于链状酯的物质共有____种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com