
| A、NH4+、Na+、NO3-、OH- |
| B、Ca2+、Na+、Cl-、CO32- |
| C、K+、H+、SO42-、OH- |
| D、Na+、K+、OH-、Cl- |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
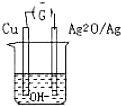 普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并产生胶体溶液呈碱性.根据这一物理化学特点科学家发明了电动势法测水泥初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+Ag 下列有关说法正确的是( )| A、工业上以黏土、石灰石为主要原料来制造水泥 |
| B、测量原理示意图中 Ag2O为负极 |
| C、负极的电极反应式为:2Cu+2OH--2e-=Cu2O+H2O |
| D、电池工作时OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝和稀盐酸反应:Al+2H+=Al3++H2↑ | ||
B、稀硝酸和碳酸钙反应:2H++CO
| ||
C、氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO
| ||
| D、用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| B、由CO和O2组成的混台物中共有NA个分子,其中的氧原子数为2NA |
| C、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,转移电子数为2NA个 |
| D、0.1mol Fe粉与足量水蒸气反应生成的H2分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
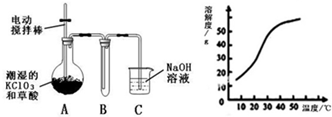 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com