


| O2 |
| 催化剂/△ |
| 乙醇 |
| 浓硫酸/△ |
| 102 |
| 12 |
 ,A与氢气发生加成反应生成E为
,A与氢气发生加成反应生成E为 ,E发生氧化反应得到F,F与X反应得到G,结合F、G的结构可知X为CO2.A转化得到B为高分子化合物,B发生信息中氧化反应得到C,则B为
,E发生氧化反应得到F,F与X反应得到G,结合F、G的结构可知X为CO2.A转化得到B为高分子化合物,B发生信息中氧化反应得到C,则B为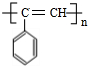 ,C为
,C为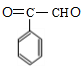 ,C转化得到D,而D的化学式为C8H10O2,应是C与氢气发生加成反应,可知D为
,C转化得到D,而D的化学式为C8H10O2,应是C与氢气发生加成反应,可知D为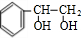 ,据此解答.
,据此解答.| 102 |
| 12 |
 ,A与氢气发生加成反应生成E为
,A与氢气发生加成反应生成E为 ,E发生氧化反应得到F,F与X反应得到G,结合F、G的结构可知X为CO2.A转化得到B为高分子化合物,B发生信息中氧化反应得到C,则B为
,E发生氧化反应得到F,F与X反应得到G,结合F、G的结构可知X为CO2.A转化得到B为高分子化合物,B发生信息中氧化反应得到C,则B为 ,C为
,C为 ,C转化得到D,而D的化学式为C8H10O2,应是C与氢气发生加反应,可知D为
,C转化得到D,而D的化学式为C8H10O2,应是C与氢气发生加反应,可知D为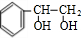 ,
,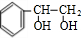 ,再发生脱水反应可以得到F,故C错误;
,再发生脱水反应可以得到F,故C错误;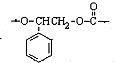 ,故D错误,
,故D错误, +2H2
+2H2| 一定条件 |
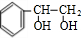 ,
, +2H2
+2H2| 一定条件 |
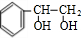 ;
; ,
, ;
;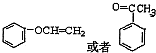 ,共有2种,
,共有2种, ;
;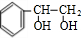 ,合成路线流程图为:
,合成路线流程图为: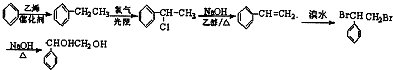 ,
, .
.


科目:高中化学 来源: 题型:

| A、分子式为C16H18O9 |
| B、0.1mol绿原酸最多与0.8mol NaOH反应 |
| C、能发生取代反应和消去反应 |
| D、能与Na2CO3反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量SO2气体通入到NaClO溶液中:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B、把Fe(OH)3溶于氢氟酸:Fe(OH)3+3H+═Fe3++3H2O |
| C、向H218O中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ |
| D、在苯酚钠溶液中通入少量的二氧化碳气体:C6H5O-+CO2+H2O═C6H5OH+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Z>R>W |
| B、气态氢化物稳定性:HW>H2R |
| C、XW4分子中各原子均满足8电子结构 |
| D、Y、Z、R三种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| y |
| 2 |
| (y-x) |
| 2 |
| (y+2-x) |
| 2 |
| (2x+2-y) |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
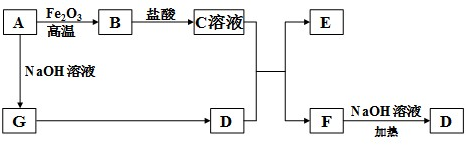
查看答案和解析>>
科目:高中化学 来源: 题型:
| 15 |
| 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用反应:Cu2Cl2+C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔.
利用反应:Cu2Cl2+C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该反应是吸热反应 |
| B、催化剂改变了该反应的焓变 |
| C、曲线b表示使用催化剂后的能量变化 |
| D、该反应的焓变△H=-510kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com