
| A. | 220mL | B. | 240mL | C. | 260mL | D. | 280mL |
分析 反应后的溶液为Mg(NO3)2、NH4NO3混合溶液,根据电子转移守恒计算生成Mg(NO3)2的物质的量,反应后的混合溶液与NaOH反应生成沉淀达最大值时,加入的NaOH与Mg(NO3)2,与NH4NO3不反应,由于生成的氨水能与Mg(NO3)2反应生成Mg(OH)2,由钠离子、硝酸根守恒可知n(NaOH)=n(NaNO3)=2n[Mg(NO3)2],进而计算需要NaOH溶液最小体积.
解答 解:反应后的溶液为Mg(NO3)2、NH4NO3混合溶液,反应后的混合溶液与NaOH反应生成沉淀达最大值时,加入的NaOH与Mg(NO3)2,与NH4NO3不反应,由于生成的氨水能与Mg(NO3)2反应生成Mg(OH)2,由钠离子、硝酸根守恒可知n(NaOH)=n(NaNO3)=2n[Mg(NO3)2],
根据电子转移守恒,2n[Mg(NO3)2]=2n(N2O)×(5-1)+n(NH4NO3)×[5-(-3)],则:
2n[Mg(NO3)2]=2×0.02mol×(5-1)+0.01mol×[5-(-3)],
解得n[Mg(NO3)2]=0.12mol
故n(NaOH)=n(NaNO3)=2n[Mg(NO3)2]=0.12mol×2=0.24mol
则加入的氢氧化钠溶液的体积至少是$\frac{0.24mol}{1mol/L}$=0.24L=240mL,
故选:B.
点评 本题考查氧化还原反应计算、混合物的计算,关键是明确沉淀最大时而消耗氢氧化钠又最少时发生的反应,注意利用电子转移守恒与原子守恒解答.


科目:高中化学 来源: 题型:解答题
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
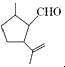 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )| A. | 先加酸性高锰酸钾溶液,后加银氨溶液,微热 | |
| B. | 先加溴水,后加酸性高锰酸钾溶液 | |
| C. | 先加新制氢氧化铜,微热,再加入溴水 | |
| D. | 先加入银氨溶液,微热,酸化后再加溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 81.5% | C. | 18.5% | D. | 21.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肼(N2H4)分子中只存在极性共价键 | |
| B. | 该反应中肼作还原剂 | |
| C. | 该反应的反应物总能量高于生成物的总能量 | |
| D. | 此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用空气吹出SO2吸收法从海水中提溴时,直接将海水氯化,然后再进行吹出、吸收可得到溴产品 | |
| B. | 从海水中提取的重水可作原子能反应堆的中子减速剂和传热介质 | |
| C. | 盐田法制盐时,所用的盐田一般分成贮水池、蒸发池、结晶池三部分 | |
| D. | 利用电渗析法,冷冻法制盐,同时也可以得到淡水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com