
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
分析 A、标况下水为液体;
B、溶液体积不明确;
C、通常状态下,气体摩尔体积大于22.4L/mol;
D、求出碳酸钠的物质的量,然后根据碳酸钠中含2个钠离子来分析.
解答 解:A、标况下水为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、溶液体积不明确,故溶液中的氯离子的个数无法计算,故B错误;
C、通常状态下,气体摩尔体积大于22.4L/mol,故NA个二氧化碳分子的体积大于22.4L,故C错误;
D、1.06g碳酸钠的物质的量为0.01mol,而碳酸钠中含2个钠离子,故0.01mol碳酸钠中含0.02NA个钠离子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:选择题
| A. | 190 | B. | 218 | C. | 436 | D. | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
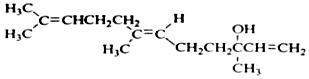 关于橙花醇叙述错误的是( )
关于橙花醇叙述错误的是( )| A. | 可使酸性 KMnO4溶液褪色 | |
| B. | 橙花醇中含有2种官能团 | |
| C. | 在浓硫酸催化下加热脱水,生成的产物不止一种 | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗240g溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+b=14 | B. | a+b=13 | C. | a+b=15 | D. | a+b=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
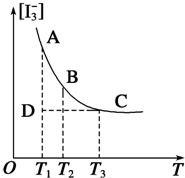 实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq).上述平衡体系中,I3-的物质的量浓度[I3-]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).
实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq).上述平衡体系中,I3-的物质的量浓度[I3-]与温度T的关系如图所示(曲线上的任何一点都表示平衡状态).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
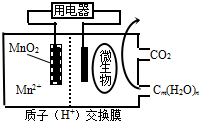
| A. | 放电过程中,H+从正极区移向负极区 | |
| B. | 分子组成为Cm(H2O)n的物质一定是糖类 | |
| C. | 微生物所在电极区放电时发生还原反应 | |
| D. | 左边电极反应式为:MnO2+4H++2e-=Mn2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2和稀H2SO4反应 | B. | HNO3和Mg(OH)2反应 | ||
| C. | Ba(OH)2溶液和HCl溶液混合 | D. | NaOH和CH3COOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO-做还原剂 | B. | Fe(OH)3在反应中被还原 | ||
| C. | 高铁酸钾中铁的化合价为+7 | D. | 制备1molK2FeO4时转移3 mol 电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com