分析:A、离子化合物中的阴离子要写出离子的电子分布并加上括号和电荷;
B、HCl中Cl原子周围8个电子,H原子周围2个电子;
C、Cl原子最外层有7个电子;
D、离子化合物中的阴离子要写出离子的电子分布并加上括号和电荷.
解答:解:A、离子化合物中的阴离子要写出离子的电子分布并加上括号和电荷,所以KOH的电子式为:
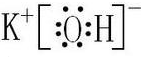
,故A错误;
B、HCl中Cl原子周围8个电子,H原子周围2个电子,所以HCl的电子式为:

,故B正确;
C、Cl原子最外层有7个电子,其电子式为:
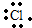
,故C错误;
D、离子化合物中的阴离子要写出离子的电子分布并加上括号和电荷,则NaF的电子式为:
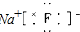
,故D错误;
故选B.
点评:本题考查电子式的书写,难度不大,注意电子式中的电子数是指最外层电子数,而不是指电子总数,阴离子要写出离子的电子分布并加上括号和电荷.



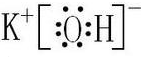 ,故A错误;
,故A错误; ,故B正确;
,故B正确;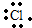 ,故C错误;
,故C错误;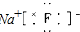 ,故D错误;
,故D错误;
