
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如右图。下列叙述正确的是( )
A.迷迭香酸分子中没有手性碳原子
B.1mol迷迭香酸最多能和9mol氢气发生加成反应
C.迷迭香酸可以发生水解反应、取代反应和酯化反应
D.1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列叙述正确的是()
| A. | Na2O与Na2O2都能和水反应生成碱,它们是碱性氧化物 | |
| B. | Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀 | |
| C. | Na2O2应保存于密封、干燥带玻璃塞的广口瓶中 | |
| D. | Na2O2可作供氧剂,而Na2O不行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:乙醇、1,2二溴乙烷、乙醚的有关物理性质如下表所示。
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 通常状况 下的状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
| 熔点/℃ | -130 | 9 | -116 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
某化学小组拟用乙醇、溴等为原料在实验室制备少量的1,2二溴乙烷,实验装置如图所示(装置A中的加热部分的仪器装置省略没有画出)。
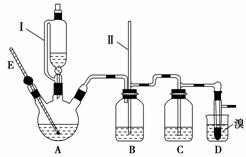
(1)仪器E的名称是_______________________________________________。
(2)仪器I是漏斗,其左部的玻璃管的作用是________(填字母)。
a.使漏斗中液体容易滴下
b.有利于吸收气体杂质
c.防止A中三颈烧瓶里的液体爆沸
(3)实验时,A中三颈烧瓶里放入几片碎瓷片的目的是__________________。
加热反应过程中,三颈烧瓶里除生成乙烯外,还可能生成的有机副产物主要是__________________________________________________________________。
(4)反应过程中,若B中长玻璃导管(II)里的液面上升,则说明可能是由于________(填“D中 出现堵塞”或“C中杂质已除尽”)造成的。
(5)反应过程中, D中需用冷水冷却盛有液溴的试管, 其主要目的是________。
说明制备1,2二溴乙烷的反应已经结束的实验现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为: 3SnCl2+12Cl-+2H3AsO3+6H+=2As
+3SnCl62-+6M。关于该反应的说法中正确的组合是 ( )
① 氧化剂是H3AsO3;② 还原性:Cl->As;③ 每生成7.5gAs,还原剂失去的电子为0.3mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①②④⑤ B.①③⑤ C.①②③④ D.只有①③
查看答案和解析>>
科目:高中化学 来源: 题型:
我国海水资源丰富,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3—等离子。合理利用海水资源和保护环境是我国可持续发展的重要保证。
Ⅰ.火力发电燃煤排放的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
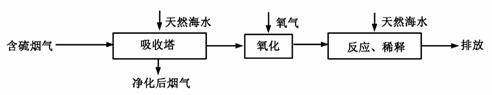
⑴天然海水的pH≈8,呈弱碱性。用离子方程式解释原因 。
⑵天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是 ;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是 。
Ⅱ.重金属离子对河流及海洋造成严重污染。某化工厂废水(pH=2.0,ρ≈1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
⑶你认为往废水中投入 (填字母序号),沉淀效果最好。
A. NaOH B. Na2S C. KI D. Ca(OH)2
⑷如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= 。
⑸如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%。若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag+)= ,是否符合排放标准 (填“是”或“否”)。(已知KSP(AgCl)=1.8×10-10mol2·L-2)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下面的反应路线及所给信息填空:
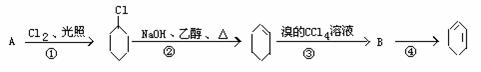
⑴A的结构简式是 ,名称是________________________
⑵① 的反应类型 ② 的反应类型_______________________
⑶反应④的化学方程式_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量过氧化氢反应,
生成氮气和水蒸气,放出256.65 kJ的热量。
(1)写出肼和过氧化氢的结构式:
肼____________________,过氧化氢______________________________________。
(2)写出反应的热化学方程式:
________________________________________________________________________
________________________________________________________________________。
(3)已知H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________kJ。
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是_______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com