
| A. | 增大压强,活化分子百分数不变,化学反应速率增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率增大 | |
| C. | 使用正催化剂,活化分子百分数增大,化学反应速率增大 | |
| D. | 加入反应物,活化分子百分数增大,化学反应速率增大 |
分析 增大浓度、增大压强,活化分子数增加;而升高温度、使用催化剂,活化分子百分数增加,均可加快反应速率,而压强影响有气体参加的反应,以此来解答.
解答 解:A.对气体参加的反应,增大压强,活化分子数增加,活化分子百分数不变,化学反应速率增大,故A正确;
B.升高温度,活化分子百分数增加,有效碰撞的机会增大,化学反应速率一定增大,故B正确;
C.使用催化剂,使活化分子百分数增加,降低了反应的活化能、反应速率加快,故C正确;
D.反应物浓度增大,活化分子百分数不一定增大,但活化分子数目增大,化学反应速率增大,而加入反应物可能为纯固体或液体,不影响反应速率,故D错误.
故选D.
点评 本题考查化学反应速率的影响因素,为高频考点,把握活化理论及反应速率增大的原因为解答的关键,侧重分析与应用能力的考查,注意活化分子数的判断,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
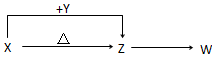 X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.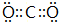 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中NO2、NO和O2的物质的量之比为2:2:1 | |
| B. | 单位时间内生成2nmolNO同时生成2nmolNO2 | |
| C. | 单位时间内生成2nmolNO同时生成nmolO2 | |
| D. | 混合气体的颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ (CO)=0.6 mol/(L•min) | |
| B. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol | |
| C. | 4 min后,若升高温度,SO2物质的量浓度变为0.7mol/L,则正反应为放热反应 | |
| D. | 4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
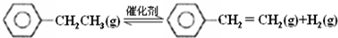
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

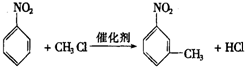 .
.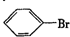 ,②
,②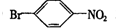 .
.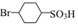 反应的化学方程式
反应的化学方程式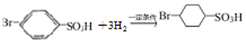 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com