
| A、3.9 g Na2O2固体中所含的离子数为0.15NA,所含的共价键数为0.05NA |
| B、14 g C2H4和C3H6的混合物中,所含H原子数为3NA |
| C、PCl3、NO2、BF3、HClO这些分子中每个原子都达到了8电子稳定结构 |
| D、电解精炼铜时,当阳极减少3.2 g铜时,转移的电子数为0.1NA |
| 3.9g |
| 78g/mol |
| m |
| M |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的氢化物是同主族元素氢化物中沸点最高,稳定性最好的 |
| B、WX2,YX2的化学键类型和立体构型都相同 |
| C、WX2是以极性键结合成的非极性分子 |
| D、W、Y、Z元素形成的最高价含氧酸的酸性由弱到强为Y<W<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把100 mL 3 mol/L的H2SO4跟100 mL 水混合,硫酸的物质的量浓度变为1.5 mol/L |
| B、把200 mL 3 mol/L的BaCl2溶液跟100 mL 3 mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol/L |
| C、把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% |
| D、把100 mL 1 mol/L的NaOH溶液取出10 mL后,NaOH溶液的浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
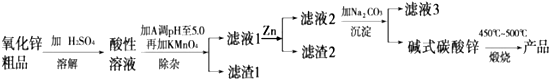
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com