
【题目】以下转化能通过一步反应实现的是
A.Al2O3→Al(OH)3B.Hg→HgSC.N2→NO2D.SiO2→H2SiO3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】冬青油又叫水杨酸甲酯,是一种重要的有机合成原料。某化学小组用水杨酸(![]() )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
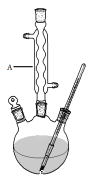
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g。
常用物理常数:
名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
请根据以上信息回答下列问题:
(1)仪器A的名称是 ,加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。
(2)制备水杨酸甲酯时,最合适的加热方法是 。
(3)实验中加入甲苯对合成水杨酸甲酯的作用是 。
(4)反应结束后,分离出甲醇采用的方法是 。
(5)实验中加入无水硫酸镁的作用是 。
本实验的产率为 (保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,根据如图所示的实验装置,回答下列问题:
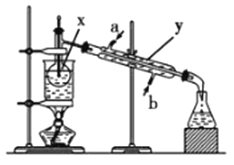
(1)写出下列仪器的名称:x_________;y_____________;z_____________。
(2)仪器y的进水口为_____________(填“a”或“b”)。
(3)请分别指出图中的一处错误_____________________,_________________。
(4)在配置1.0mol/L盐酸溶液时,下列操作会导致所配溶液浓度偏大的是___________(填写字母,下同);浓度不变的是_______。
A.用量筒量取浓盐酸时,俯视量筒刻度线
B.容量瓶未干燥即用来配置溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容后,将容量瓶倒置摇匀,发现液面低于刻度线,继续加水至刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
F.未进行洗涤操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常温下的无色无味气体。则甲的电子式为__;常温下丁溶液pH___7(填“>”“<”或“=”),用离子方程式解释原因____________;
(2)若丁为能使品红褪色的无色气体,丁与水反应生成戊,丙为常见红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。回答下列问题:
①A在周期表中位置为___________;
②向丁的水溶液中滴入紫色石蕊试液,现象为_____________________;
③写出加热条件下上述生成丙的化学方程式__________________;
④向MCl2的溶液中通入丁,生成白色MCl沉淀,写出该反应的离子方程式__________;
⑤已知常温下弱电解质的电离平衡常数如下:一水合氨Kb=1.8×10-5,戊:Ka1=1.3×10-2, Ka2 = 6.3×10 -8。若一水合氨与丁恰好完全反应生成正盐,则浓度为0.1 mol/L的该正盐溶液呈____性(填“酸”或“碱”或“中”);调整二者反应的比值可使溶液呈中性,此时溶液中![]() ____2(填“>”“<”或“=”)。
____2(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com