
 =35g;
=35g; =5.25g,混合物加热后剩余固体的质量为6.55g+5.25g=11.8g,加热固体生成的氧气质量为16.6g-11.8g=4.8g,则:
=5.25g,混合物加热后剩余固体的质量为6.55g+5.25g=11.8g,加热固体生成的氧气质量为16.6g-11.8g=4.8g,则: 2KCl+3O2↑
2KCl+3O2↑ =12.25g,
=12.25g, =
= ,KC1溶液的密度为l.72g/cm3,则氯化钾溶液的物质的量浓度为
,KC1溶液的密度为l.72g/cm3,则氯化钾溶液的物质的量浓度为 mol/L=5.99mol/L,
mol/L=5.99mol/L,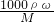 计算氯化钾溶液的物质的量浓度.
计算氯化钾溶液的物质的量浓度.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
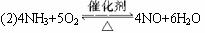
实验中所用试剂不超出下列范围:
①NH4Cl和Ca(OH)2的混合物 ②4∶1氨水 ③NaOH固体 ④KClO3和MnO2的混合物 ⑤蒸馏水⑥NH4HCO3固体 ⑦6 mol·L-1 NaOH溶液 ⑧0.5 mol·L-1 NaOH溶液 ⑨酚酞试液 ⑩碱石灰 ⑾浓H2SO4 ?⑿CuO
试完成下列问题:
(1)微型叉形管中液态物质A是__________,固体物质B是__________。
(2)C处发生反应的化学方程式是_______________________________________。
(3)混合物D是为了检验酸性物质的生成而放入的,其组成是__________,实验过程中的现象是_______________________。
(4)E处球形玻璃管的作用是________________________________________。
(5)F处的棉花应蘸取的物质是_________________________________,其反应的化学方程式是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
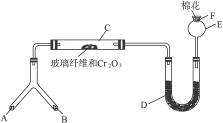
微型化学实验具有装置小巧,节约药品,操作简便,现象明显,安全可靠,减少污染等特点,下图是某同学设计的NH3的催化氧化并检验反应生成的酸性物质的微型装置(图中必要的铁架台、铁夹、微型酒精灯等均略去)。
实验中所用试剂不超出下列范围:
①NH4Cl和Ca(OH)2的混合物 ②4∶1氨水 ③NaOH固体 ④KClO3和MnO2的混合物 ⑤蒸馏水⑥NH4HCO3固体 ⑦6 mol·L-1 NaOH溶液 ⑧0.5 mol·L-1 NaOH溶液 ⑨酚酞试液 ⑩碱石灰 11浓H2SO4 ?12CuO
试完成下列问题:
(1)微型叉形管中液态物质A是__________,固体物质B是__________。
(2)C处发生反应的化学方程式是_______________________________________。
(3)混合物D是为了检验酸性物质的生成而放入的,其组成是__________,实验过程中的现象是_______________________。
(4)E处球形玻璃管的作用是________________________________________。
(5)F处的棉花应蘸取的物质是_________________________________,其反应的化学方程式是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
取一定量的KClO3和MnO2的混合物共热制取O2,反应开始时MnO2在混合物中的质量分数为20%,当反应进行到MnO2在混合物中的质量分数为25%时,求KClO3的分解百分率。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com