

 ;写出聚乙烯的一种用途食品包装袋.
;写出聚乙烯的一种用途食品包装袋.分析 (1)聚乙烯是乙烯的加成产物,可用于包装食品;
(2)乙烯与水加成可得到乙醇;苯中的氢被硝基取代可得到硝基苯;
(3)乙醇与乙酸发生酯化反应,碳与水反应生成一氧化碳和氢气,一氧化碳和氢气可合成甲醇;
解答 解:(1)聚乙烯是乙烯的加成产物,结构简式是 ,可用于包装食品,故答案为:
,可用于包装食品,故答案为: ;食品包装袋;
;食品包装袋;
(2)乙烯与水加成可得到乙醇;苯中的氢被硝基取代可得到硝基苯,反应①属于加成反应;反应③属于取代(或硝化)反应,故答案为:加成;取代(或硝化);
(3)乙醇与乙酸发生酯化反应:CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O,碳与水反应生成一氧化碳和氢气:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,一氧化碳和氢气可合成甲醇:CO+2H2→CH3OH,故答案为:②CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O;④C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2;⑤CO+2H2→CH3OH.
点评 本题考查有机物的性质和化学方程式的书写,难度不大,本题注意把握常见有机物的官能团的性质,记住反应条件,常见有机物反应的化学方程式要会写.


科目:高中化学 来源: 题型:解答题
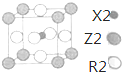 X、Y、Z、W、R是原子序数依次增大的前四周期元素(稀有气体除外).X的基态原子中的电子平均分布在三个不同的能级中;Y的族序数是其周期数的三倍;Z的基态原子核外无未成对电子;W为前四周期中电负性最小的元素;元素R位于周期表的第10列.
X、Y、Z、W、R是原子序数依次增大的前四周期元素(稀有气体除外).X的基态原子中的电子平均分布在三个不同的能级中;Y的族序数是其周期数的三倍;Z的基态原子核外无未成对电子;W为前四周期中电负性最小的元素;元素R位于周期表的第10列.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| B. | 可用蘸浓硫酸的棉棒检验输送氨气的管道是否漏气 | |
| C. | 碘是人体必需微量元素,所以要适量吃富含碘酸根原子团的食物 | |
| D. | 黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘氨酸 | B. | 丙氨酸 | C. | 苯丙氨酸 | D. | 葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只可能含有离子键 | |
| C. | 在工业上X、Y都可以直接用加热分解的方法冶炼 | |
| D. | 若W与Y的原子序数相差5,则二者形成的化合物的化学式一定为Y2W3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 C
C ;
; ;该反应类型为消去反应.
;该反应类型为消去反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.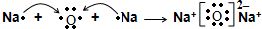
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com