
| A. | 水 | B. | 煤油 | C. | 沙子 | D. | 泡沫灭火器 |
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应:Fe-2e-═Fe2+ | |
| B. | 阴极反应:2H++2e-═H2↑ | |
| C. | 在电解过程中工业废水由酸性变为碱性 | |
| D. | 可以将铁电极改为石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金的熔点介于钠、铝之间 | |
| B. | 钠或铝形成的氧化物均为碱性氧化物 | |
| C. | 等质量钠和铝分别与足量的盐酸反应钠产生的气体多 | |
| D. | 若合金中n(Na)=n(Al),将其投入到足量的水中,可得无色透明溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有CO32- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO42- | D. | 可能含有SO42-也可能含有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
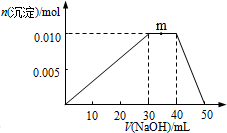
| A. | NH4Al(SO4)2的电离方程式为:NH4Al(SO4)2?NH4++Al3++2SO42- | |
| B. | m点反应的离子方程式:NH4++OH-═NH3•H2O | |
| C. | 反应过程中SO42-的浓度始终保持不变 | |
| D. | 由图象可知所滴NaOH溶液的浓度为0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

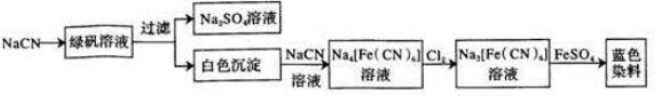
 .
. 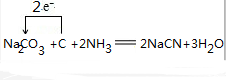 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
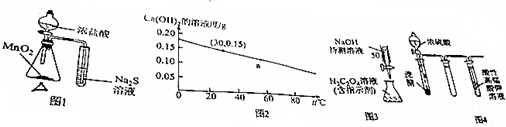
| A. | 图1的装置可用于比较MnO2、Cl2、S的氧化性 | |
| B. | 图2可知:30℃时Ca(OH)2溶液的浓度一定大于60℃时的温度 | |
| C. | 图3的装置可用于已知浓度的H2C2O4溶液测定未知浓度的NaOH溶液 | |
| D. | 图4的实验现象:酸性高锰酸钾溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
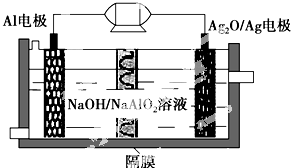 Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )
Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )| A. | 工作时正极发生还原反应 | |
| B. | 当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol | |
| C. | Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O | |
| D. | 工作时电解液中的Na+透过隔膜移向Al电极放电充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com