

| A. | 用图1装置分离乙醇和乙酸 | B. | 用图2装置制取氨气 | ||
| C. | 用图3装置进行氨气的喷泉实验 | D. | 用图4装置进行石油的分馏实验 |
分析 A.乙醇和乙酸互溶,为溶液;
B.氨气密度比空气小;
C.氨气极易溶于水;
D.温度计位置错误,温度计应该测量蒸气温度而不是液体温度,且冷凝管中下口为进水口、上口为出水口.
解答 解:A.乙醇和乙酸互溶,为溶液,能透过滤纸,不能用过滤分离,故A错误;
B.氨气密度比空气小,可用向下排空气法收集,故B正确;
C.氨气极易溶于水,可进行氨气的喷泉实验,故C正确;
D.对石油进行蒸馏时,温度计测量蒸气温度,所以温度计水银球应该位于蒸馏烧瓶支管口处,且冷凝管中的水应该是下口进水、上口出水,否则易炸裂冷凝管,故D错误;
故选BC.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
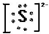
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电子式: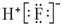 | |
| B. | H、D、T是氢元素的三种不同核素,互称同位素 | |
| C. | K+离子的结构示意图: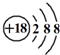 | |
| D. | 溴化钠的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
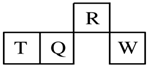
| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | R的气态氢化物的水溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
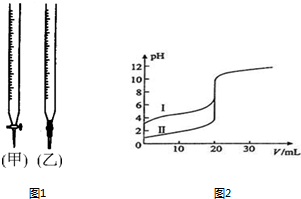 请回答:
请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
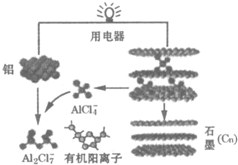
| A. | 放电时,有机阳离子向铝电极方向移动 | |
| B. | 充电时,铝电极连接外加电源的正极,石墨电极连接外加电源的负极 | |
| C. | 放电时负极的电极反应为:Al-3e-+7AlCl4-=4Al2Cl7- | |
| D. | 该电池的工作原理为:3Cn+4Al2Cl7-$?_{充电}^{放电}$3CnAlCl4+Al+AlCl4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | N为直流电源的正极 | |
| B. | 乙池的总反应为4AgN03+2H20═4Ag+4HNO3+O2↑ | |
| C. | 丙池的反应符合电解精炼铜原理 | |
| D. | 要使丁池电解质溶液复原,需加适量的CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
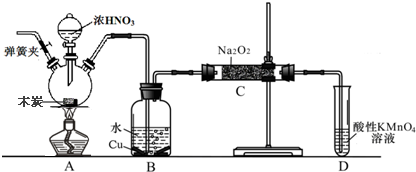
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com