
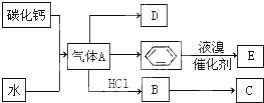
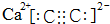 ;D的空间构型为平面结构,键角为120°;
;D的空间构型为平面结构,键角为120°; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应 其反应类型为加聚反应
其反应类型为加聚反应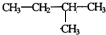 .
. 分析 碳化钙与水反应生成气体A为HC≡CH,D是一种植物生长调节剂,用它可以催熟果实,则D为乙烯,乙炔与氢气发生加成反应得到乙烯,乙炔与HCl发生加成反应生成B,B发生加聚反应得到C,则B为CH2=CHCl,C为 ,苯与液溴在催化剂条件下发生取代反应生成E为
,苯与液溴在催化剂条件下发生取代反应生成E为 ,据此解答.
,据此解答.
解答 解:碳化钙与水反应生成气体A为HC≡CH,D是一种植物生长调节剂,用它可以催熟果实,则D为乙烯,乙炔与氢气发生加成反应得到乙烯,乙炔与HCl发生加成反应生成B,B发生加聚反应得到C,则B为CH2=CHCl,C为 ,苯与液溴在催化剂条件下发生取代反应生成E为
,苯与液溴在催化剂条件下发生取代反应生成E为 .
.
(1)碳化钙的: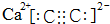 ;D为乙烯,C原子采取sp2杂化,键角约为120°,
;D为乙烯,C原子采取sp2杂化,键角约为120°,
故答案为: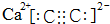 ;120°;
;120°;
(2)碳化钙与水反应制取乙炔的化学方程式为:CaC2+2H2O→Ca(OH)2+HC≡CH↑,
苯和液溴反应生成E的化学方程式: +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,属于取代反应,
+HBr,属于取代反应,
故答案为:CaC2+2H2O→Ca(OH)2+HC≡CH↑; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr;取代反应;
+HBr;取代反应;
(3)B→C是氯乙烯发生加聚反应生成聚氯乙烯,反应化学方程式为:nCH2=CHCl$\stackrel{催化剂}{→}$ ,属于加聚反应,
,属于加聚反应,
故答案为:nCH2=CHCl$\stackrel{催化剂}{→}$ ;加聚反应;
;加聚反应;
(4)E为 ,E的苯环上的一氯代物有邻、间、对三种,故答案为:3;
,E的苯环上的一氯代物有邻、间、对三种,故答案为:3;
(5)E为 ,E 的官能团名称为 溴原子,故答案为:溴原子;
,E 的官能团名称为 溴原子,故答案为:溴原子;
(6)分子式为C5H12有机物,其中一种结构的核磁共振氢谱共有4种吸收峰,其峰面积之比为1:2:3:6,其结构简式为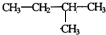 ,
,
故答案为: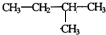 .
.
点评 本题考查有机物推断,需要学生熟练掌握有机物的性质与转化、有条件的同分异构体的书写方法,题目基础性强,贴近教材,注意对基础知识的理解掌握.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
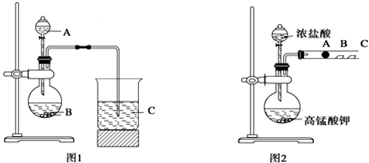
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
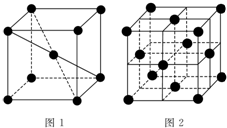 1 183K以下纯铁晶体的基本结构单元如图1所示,1 183K以上转变为图2所示结构的基本结构单元,在1中铁原子的配位数为8;其中为密堆积的是2(填“1”或“2”);1中的空间利用率为68%.
1 183K以下纯铁晶体的基本结构单元如图1所示,1 183K以上转变为图2所示结构的基本结构单元,在1中铁原子的配位数为8;其中为密堆积的是2(填“1”或“2”);1中的空间利用率为68%.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com