
£Ø12·Ö£©20 LŗćČŻµÄĆܱÕČŻĘ÷ÖŠ£¬¼ÓČė3 mol SO3(g)ŗĶ1 molŃõĘų£¬ŌŚÄ³ĪĀ¶ČĻĀŹ¹Ęä·“Ó¦£¬·“Ó¦ÖĮ4 minŹ±£¬ŃõĘųµÄÅضČĪŖ0.06 mol/L£¬µ±·“Ó¦µ½8 minŹ±£¬·“Ó¦µ½“ļĘ½ŗā”£
(1)0 min”«4 minÄŚÉś³ÉO2µÄĘ½¾łĖŁĀŹ£ŗ
v(O2)£½____________mol/(L”¤min)”£
(2)Õūøö¹ż³ĢÖŠ£¬ø÷ĪļÖŹµÄÅضČÓėŹ±¼ä¹ŲĻµČēĻĀĶ¼ĖłŹ¾£¬ŌņøĆĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżK£½________________”£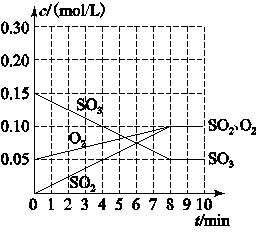
(3)ČōĘšŹ¼Ź±°“ĻĀ±ķŹż¾ŻĶ¶ĮĻ£¬ĻąĶ¬ĪĀ¶ČĻĀ“ļµ½Ę½ŗāŹ±£¬ČżŃõ»ÆĮņÅØ¶Č“óÓŚ0.05 mol/LµÄŹĒ________£¬“ĖŹ±µÄĘ½ŗā³£ŹżÓė(2)Š”Ģā±Č½Ļ________(Ģī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±)”£
| | A | B | C | D |
| SO3 | 1 mol | 3 mol | 3 mol | 0 mol |
| SO2 | 2 mol | 1.5 mol | 0 mol | 6 mol |
| O2 | 2 mol | 1 mol | 0 mol | 5 mol |

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
£Ø12·Ö£©20 LŗćČŻµÄĆܱÕČŻĘ÷ÖŠ£¬¼ÓČė3 mol SO3(g)ŗĶ1 molŃõĘų£¬ŌŚÄ³ĪĀ¶ČĻĀŹ¹Ęä·“Ó¦£¬·“Ó¦ÖĮ4 minŹ±£¬ŃõĘųµÄÅضČĪŖ0.06mol/L£¬µ±·“Ó¦µ½8 minŹ±£¬·“Ó¦µ½“ļĘ½ŗā”£
(1)0 min”«4minÄŚÉś³ÉO2µÄĘ½¾łĖŁĀŹ£ŗ
v(O2)£½____________mol/(L”¤min)”£
(2)Õūøö¹ż³ĢÖŠ£¬ø÷ĪļÖŹµÄÅضČÓėŹ±¼ä¹ŲĻµČēĻĀĶ¼ĖłŹ¾£¬ŌņøĆĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżK£½________________”£
(3)ČōĘšŹ¼Ź±°“ĻĀ±ķŹż¾ŻĶ¶ĮĻ£¬ĻąĶ¬ĪĀ¶ČĻĀ“ļµ½Ę½ŗāŹ±£¬ČżŃõ»ÆĮņÅØ¶Č“óÓŚ0.05 mol/LµÄŹĒ________£¬“ĖŹ±µÄĘ½ŗā³£ŹżÓė(2)Š”Ģā±Č½Ļ________(Ģī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±)”£
|
| A | B | C | D |
| SO3 | 1 mol | 3 mol | 3 mol | 0 mol |
| SO2 | 2 mol | 1.5 mol | 0 mol | 6 mol |
| O2 | 2 mol | 1 mol | 0 mol | 5 mol |
(4)ĪļÖŹµÄÅØ¶Č²»ŌŁøÄ±ä±źÖ¾øĆ·“Ó¦ŅŃ“ļĘ½ŗā£¬ĻĀĮŠ»¹æÉŅŌĖµĆ÷øĆ·“Ó¦ŅŃ“ļĘ½ŗāµÄŹĒ________(ĢīŠņŗÅ)”£
¢ŁĢåĻµÄŚŃ¹Ēæ²»ŌŁøıä
¢ŚČŻĘ÷ÄŚĘųĢåµÄĆÜ¶Č²»ŌŁøıä
¢Ū»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁøıä
¢ÜvÕż(SO3)£½2vÄę(O2)
¢Żn(SO3)”Ćn(O2)”Ćn(SO2)£½2”Ć1”Ć2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011-2012Ń§ÄźÉ½¶«Ź”øßČż10ŌĀ·ŻÖŹĮæ¼ģ²ā»ÆѧŹŌ¾ķ ĢāŠĶ£ŗĢīæÕĢā
£Ø12·Ö£©20 LŗćČŻµÄĆܱÕČŻĘ÷ÖŠ£¬¼ÓČė3 mol SO3(g)ŗĶ1 molŃõĘų£¬ŌŚÄ³ĪĀ¶ČĻĀŹ¹Ęä·“Ó¦£¬·“Ó¦ÖĮ4 minŹ±£¬ŃõĘųµÄÅضČĪŖ0.06 mol/L£¬µ±·“Ó¦µ½8 minŹ±£¬·“Ó¦µ½“ļĘ½ŗā”£
(1)0 min”«4 minÄŚÉś³ÉO2µÄĘ½¾łĖŁĀŹ£ŗ
v(O2)£½____________mol/(L”¤min)”£
(2)Õūøö¹ż³ĢÖŠ£¬ø÷ĪļÖŹµÄÅضČÓėŹ±¼ä¹ŲĻµČēĻĀĶ¼ĖłŹ¾£¬ŌņøĆĪĀ¶ČĻĀµÄĘ½ŗā³£ŹżK£½________________”£

(3)ČōĘšŹ¼Ź±°“ĻĀ±ķŹż¾ŻĶ¶ĮĻ£¬ĻąĶ¬ĪĀ¶ČĻĀ“ļµ½Ę½ŗāŹ±£¬ČżŃõ»ÆĮņÅØ¶Č“óÓŚ0.05 mol/LµÄŹĒ________£¬“ĖŹ±µÄĘ½ŗā³£ŹżÓė(2)Š”Ģā±Č½Ļ________(Ģī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±)”£
|
|
A |
B |
C |
D |
|
SO3 |
1 mol |
3 mol |
3 mol |
0 mol |
|
SO2 |
2 mol |
1.5 mol |
0 mol |
6 mol |
|
O2 |
2 mol |
1 mol |
0 mol |
5 mol |
(4)ĪļÖŹµÄÅØ¶Č²»ŌŁøÄ±ä±źÖ¾øĆ·“Ó¦ŅŃ“ļĘ½ŗā£¬ĻĀĮŠ»¹æÉŅŌĖµĆ÷øĆ·“Ó¦ŅŃ“ļĘ½ŗāµÄŹĒ________(ĢīŠņŗÅ)”£
¢ŁĢåĻµÄŚŃ¹Ēæ²»ŌŁøıä
¢ŚČŻĘ÷ÄŚĘųĢåµÄĆÜ¶Č²»ŌŁøıä
¢Ū»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁøıä
¢ÜvÕż(SO3)£½2vÄę(O2)
¢Żn(SO3)”Ćn(O2)”Ćn(SO2)£½2”Ć1”Ć2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗÕć½Ź”Ä£ÄāĢā ĢāŠĶ£ŗĢīæÕĢā
 2NH3(g)£» ”÷H=-92.4kJ”¤mol-1”£
2NH3(g)£» ”÷H=-92.4kJ”¤mol-1”£ 
 2NH3(g)µÄĘ½ŗā³£ŹżK= ________”££Ø±£ĮōŠ”ŹżŅ»Ī»£©KÖµŌ½“󣬱ķĆ÷·“Ó¦“ļµ½Ę½ŗāŹ±_________£ØĢī±źŗÅ£©”£
2NH3(g)µÄĘ½ŗā³£ŹżK= ________”££Ø±£ĮōŠ”ŹżŅ»Ī»£©KÖµŌ½“󣬱ķĆ÷·“Ó¦“ļµ½Ę½ŗāŹ±_________£ØĢī±źŗÅ£©”£
 2NH3(g) + O2(g)”£”÷H = a kJ”¤mol-1 ½ųŅ»²½ŃŠ¾æNH3Éś³ÉĮæÓėĪĀ¶ČµÄ¹ŲĻµ£¬³£Ń¹ĻĀ“ļµ½Ę½ŗāŹ±²āµĆ²æ·ÖŹµŃ鏿¾ŻČēĻĀ±ķ
2NH3(g) + O2(g)”£”÷H = a kJ”¤mol-1 ½ųŅ»²½ŃŠ¾æNH3Éś³ÉĮæÓėĪĀ¶ČµÄ¹ŲĻµ£¬³£Ń¹ĻĀ“ļµ½Ę½ŗāŹ±²āµĆ²æ·ÖŹµŃ鏿¾ŻČēĻĀ±ķ 
 2NH3(g) ¦¤H= £92 .4kJ”¤mol-1
2NH3(g) ¦¤H= £92 .4kJ”¤mol-1 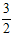 O2(g) ¦¤H=_____________kJ”¤mol-1
O2(g) ¦¤H=_____________kJ”¤mol-1 ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012ÄźÉ½¶«Ź”×Ķ²©Ņ»ÖŠøßæ¼»ÆŃ§ČżÄ£ŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗ½ā“šĢā
 O2£Øg£©ØTH2O£Øl£©”÷H2=-285.8kJ/mol
O2£Øg£©ØTH2O£Øl£©”÷H2=-285.8kJ/mol
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com