
 硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤.请回答下列问题:
硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤.请回答下列问题:| 催化剂 |
| △ |
| ||
| t |
| 催化剂 |
| △ |
| ||
| t |
| ||
| 0.5 |
| 20.16L |
| 21.28L |


科目:高中化学 来源: 题型:

| A、图Ⅰ表示:反应物的总能量高于生成物的总能量,则反应放热,△H<0 |
| B、图Ⅱ表示:反应物的总能量低于生成物的总能量,则反应吸热,△H>0 |
| C、H2与O2化合生成液态水的能量变化过程可用图Ⅰ来表现 |
| D、符合图Ⅱ所示能量变化的化学反应,必须要加热才能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的原子序数:a>b>c>d |
| B、a-b=n-m |
| C、元素的非金属性:R>Z |
| D、最高价氧化物对应的水化物的碱性:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
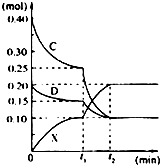 A、B、C、D、E是中学常见的单质,X是化合物.A、B均为常见的金属,且在地壳中的含量分别为金属元素的前两位;常温下C是气态非金属单质,可以燃烧;D是空气主要成份之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:
A、B、C、D、E是中学常见的单质,X是化合物.A、B均为常见的金属,且在地壳中的含量分别为金属元素的前两位;常温下C是气态非金属单质,可以燃烧;D是空气主要成份之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
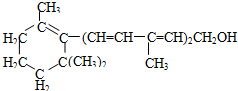
 ,分子式:
,分子式: )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: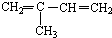 与Br2以物质的量之比为1:1反应,所得产物有
与Br2以物质的量之比为1:1反应,所得产物有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 一种Al-Fe合金的立体晶胞如图所示.请据此回答下列问题:
一种Al-Fe合金的立体晶胞如图所示.请据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、白,红,白 |
| B、红,黑,红 |
| C、红,红,红 |
| D、白,黑,白 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com