
分析 (1)活泼性强的金属作负极,活泼性弱的作正极,正极上溶液中的阳离子得电子;
(2)若将电解质溶液改为硫酸铜溶液,仍是活泼性强的金属Zn作负极;根据转移电子相等计算生成氢气的体积,根据转移电子相同计算阴极上生成铜的质量,两个电极的差为减少的锌的质量与析出铜质量的和.
解答 解:(1)活泼性强的金属Zn作负极,活泼性弱的Cu作正极,正极上溶液中的氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,负极上是金属铜失电子的氧化反应,电极反应式为:Zn-2e-=Zn2+;故答案为:Cu;Zn-2e-=Zn2+;
(2)若将电解质溶液改为硫酸铜溶液,仍是活泼性强的金属Zn作负极,Zn失去电子生成锌离子,其电极反应为:Zn-2e-=Zn2+;锌片的质量减少了6.5g,转移电子是0.1mol,正极上铜离子得电子生成Cu,电极反应式为:Cu2++2e-═Cu;电解硫酸铜溶液时,根据转移电子相等,得析出铜的质量是6.4g,两个电极的差为减少的锌的质量与析出铜质量的和,所以两个电极的质量差=6.5g+6.4g=12.9g;
故答案为:Zn;Cu2++2e-═Cu;12.9g.
点评 本题考查原电池的工作原理,根据原电池电极上得失电子来判断正负极,侧重于基础知识的考查,题目难度不大,注意两极电极反应转移的电子数目相等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
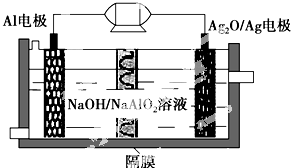 Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )
Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示.该电池工作时总反应式为2Al+3Ag2O+2NaOH═2NaAlO2+6Ag+H2O,则下列说法错误的是( )| A. | 工作时正极发生还原反应 | |
| B. | 当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol | |
| C. | Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O | |
| D. | 工作时电解液中的Na+透过隔膜移向Al电极放电充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 加入试剂 | 离子方程式 |
| NH4Cl(AlCl3)溶液 | ||
| NaHCO3(Na2CO3)溶液 | ||
| Fe 粉(Al粉) | ||
| FeCl3(FeCl2)溶液 |
 15.(18分)
15.(18分) ,反应类型是加聚反应.
,反应类型是加聚反应.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁腐蚀的负极反应为:Fe-3e-=Fe3+ | |
| B. | Mg-Al及NaOH溶液构成的原电池中负极材料为Mg | |
| C. | 无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分NaClO | |
| D. | H2-O2燃料电池中电解液为H2SO4,则正极反应式为:O2+4e-=2O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
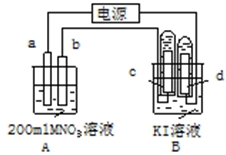 如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答
如图装置中:b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答查看答案和解析>>
科目:高中化学 来源: 题型:解答题
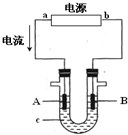 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | ||
| A | 某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 溶液中一定含有CO32- |
| B | 将砂纸打磨过的铝箔置于酒精灯外焰上灼烧,熔化的铝以小液滴的形式滴落下来 | Al的熔点低,加热时Al熔化 |
| C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+,无Κ+ |
| D | 向某溶液中先加几滴KSCN溶液,无明显现象,再滴加氯水,溶液变红 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com