

分析 (1)根据仪器A特点书写其名称,为了充分冷却气体,应该下口进水;
(2)二氧化硫具有还原性,能够与实验室反应生成硫酸,据此写出反应的化学方程式;
(3)氢氧化钠应该盛放在碱式滴定管中,根据碱式滴定管的排气泡法进行判断;根据滴定终点时溶液的pH及常见指示剂的变色范围选用正确的指示剂;根据滴定管的刻度可确定溶液的体积;
(4)根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,再计算出该葡萄酒中的二氧化硫含量;
(5)根据盐酸是挥发性酸,挥发的酸消耗氢氧化钠判断对测定结果的影响;可以选用非挥发性的酸或用蒸馏水代替葡萄酒进行对比实验,减去盐酸挥发的影响.
解答 解:(1)根据仪器A的构造可知,仪器A为冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以应该进水口为b,
故答案为:冷凝管或冷凝器;b;
(2)双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,
故答案为:SO2+H2O2=H2SO4;
(3)氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用③的方法;滴定终点时溶液的pH=8.8,应该选择酚酞做指示剂(酚酞的变色范围是8.2~10.0),终点时溶液颜色的变化为由无色变为红色;若根据滴定管的刻度可知消耗NaOH溶液的体积为26.5mL-1.5mL=25mL,
故答案为:③;由无色变为红色;25;
(4)根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×(0.0900mol/L×0.025L)×64g/mol=0.072g,该葡萄酒中的二氧化硫含量为:$\frac{0.72g}{0.3L}$=0.24g/L,
故答案为:0.24;
(5)由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响,
故答案为:原因:盐酸易挥发;改进措施:用不挥发的强酸如硫酸代替盐酸(或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响).
点评 本题为一道高考题,考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生灵活应用所学知识的能力.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
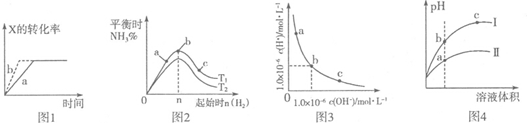
| A. | 图l所示,反应:X(g)+2Y(g)═3Z(g),b的压强一定比a大 | |
| B. | 图2表示合成氨反应,温度T1和T2对应的平衡常数为K1、K2,则:T1<T2,K1>K2 | |
| C. | 图3表明,该温度下,加入FeCl3不可能引起由b向a的变化 | |
| D. | 图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
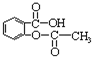 b.烯烃
b.烯烃 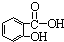 c.炔烃
c.炔烃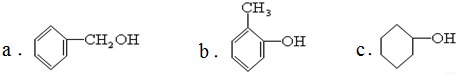
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水的反应:2Na+2H+═2Na++H2↑ | |
| B. | 氯化铝溶液加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 铜与硝酸银溶液反应:Cu+Ag+═Ag+Cu2+ | |
| D. | 少量SO2通入NaOH溶液:SO2+2OH-═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入少量NaOH固体,能促进水的电离 | |
| B. | c(Na+)=2c(S2-)+c(OH-)+c(HS-) | |
| C. | 向Na2S溶液中加水稀释,其所有离子的浓度都减小 | |
| D. | 溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 三种不同大小的球代表三种相对大小不同的短周期元素原子,则有关该物质的说法不正确的( )
三种不同大小的球代表三种相对大小不同的短周期元素原子,则有关该物质的说法不正确的( )| A. | 该物质结构简式为:CHCl=CCl2 | B. | 该物质存在顺反异构 | ||
| C. | 该物质可由乙炔通过加成反应得到 | D. | 该物质难溶于水比水重. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com