
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是
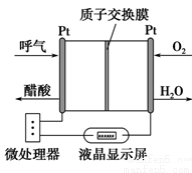
A.该电池的负极反应式为:CH3CH2OH+ 3H2O-12e-===2CO2↑+12H+
B.该电池的正极反应式为:O2+4e-+4H+===2H2O
C.电流由O2所在的铂电极经外电路流向另一电极
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源:2014-2015学年浙江省杭州市高二10月月考化学试卷(解析版) 题型:实验题
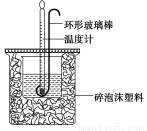
(6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是_______________________________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是________________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1________ΔH(填“<”、“>”或“=”),理由是__________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州市高一10月月考化学试卷(解析版) 题型:选择题
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是
A.0.01 mol·L-1的蔗糖溶液 B.0.01 mol·L-1的CaCl2溶液
C.0.02 mol·L-1的NaCl溶液 D.0.02 mol·L-1的CH3COOH溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:实验题
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,则至少需要称量NaOH固体________g。
Ⅱ.测定中和热的实验装置如图所示
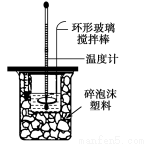
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值57.3 kJ/mol):________ 。
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
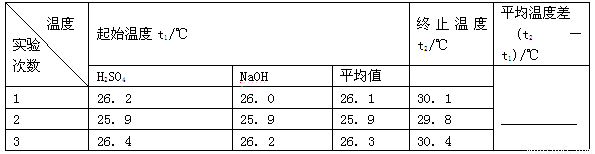
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=________(取小数点后一位)。
③上述实验结果的数值与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:选择题
下图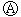 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通 后,使c、d两点短路.
后,使c、d两点短路.
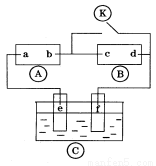
下列叙述正确的是
A.a为直流电源的负极
B.d极发生的反应为2H++2e-=H2↑
C.f电极为铜板
D.e极发生的反应为Cu-2e- =Cu2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:选择题
反应A(g)+3B(g) 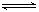 2C(g)+2D(g),在不同情况下测得反应速率,其反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其反应速率最快的是
A.υ(D)=0.4 mol / ?L·s?
B.υ(C)=0.5 mol / ?L·s?
C.υ(B)=0.6 mol / ?L·s?
D.υ(A)=0.15 mol / ?L·s?
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:实验题
(14分)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量,某实验小组做了如下实验:
Ⅰ.称量4.910g三草酸合铁酸钾晶体,配制成250mL溶液。
Ⅱ.取所配溶液25.00mL于锥形瓶中,加稀硫酸酸化,滴加KMnO4溶液至草酸根(C2O42?)恰好全部氧化成二氧化碳,同时MnO4?被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至溶液的黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
Ⅲ.用0.01000mol/L KMnO4溶液滴定步骤Ⅱ所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4?被还原成Mn2+ 。
Ⅳ.重复步骤Ⅱ、步骤Ⅲ操作,滴定消耗0.01000mol/L KMnO4溶液19.98mL
请回答下列问题:
(1)滴定过程中需添加的指示剂是(若不需要请说明理由)
(2)加入锌粉的目的是 。
(3)写出步骤Ⅲ中发生反应的离子方程式 。
(4)实验测得该晶体中铁的质量分数为 ;X= 。
(5)在步骤Ⅱ中,若加入的KMnO4的溶液的量不够,则测得的铁含量 ;(选填“偏低”“偏高”“不变”,下同)若加入的锌粉的量不够,则测的铁的含量 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
常温下,①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。有关上述溶液的比较中,不正确的是
A.水电离的c(H+):①=②=③=④
B.将②、③溶液混合后,pH=7,消耗溶液的体积:②>③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向溶液中加入100mL水后,溶液的pH:③>④>②>①
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:实验题
(9分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用来消
毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,欲准确测定过氧化
氢的含量。请填写下列空白:
(1)取10.00 mL密度为ρg/mL的过氧化氢溶液稀释至250mL。移取稀释后的过氧化
氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为 。
(3)滴定时,将高锰酸钾标准溶液注入 (填“酸式”或“碱式”)滴定管
中,滴定到达终点的现象是 。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中
过氧化氢的质量分数为 。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 (填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com