
【题目】氢气因热值高、来源广、产物无污染,常被人们看做一种理想的“绿色能源”,氢气的制取是氢能源利用领域的研究热点。

(1)图1为用电解法制备H2,写出阳极的电极反应式:____________________________。
(2)从可持续发展考虑,太阳能光解水制氢是获取H2的最好途径,但迄今仍然存在诸多问题,如光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,能量转化效率低等,这些都阻碍了光解水的实际应用,需设计课题进一步研究解决。下列设想符合研究方向的是________。
A.将研究方向专注于紫外光区,无需考虑可见光区
B.研究光腐蚀机理,寻找高稳定性,不产生光腐蚀的制氢材料
C.研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料
D.研究新的光解水的催化机制,使利用红外光进行光解水制氢成为可能
(3)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=-206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH2=-247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:__________________________________。
(4)利用废弃的H2S的热分解可生产H2:2H2S(g)2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图2所示:
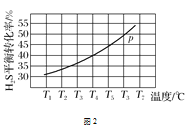
①温度为T4 ℃时,初始体积为1 L,t分钟后,反应达到平衡,该温度下的平衡常数K=________。
②若保持恒温T ℃,将一定量的H2S(g)通入到恒压密闭容器中,反应一段时间后,压强为p的体系恰好达到平衡,试在图3上画出不同起始压强下H2S转化率的趋势图。 _________________

【答案】4CO32-+2H2O-4e-=O2↑+4HCO3- BCD CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=-165.0 kJ·mol-1 ![]() 或2.2 ×10-2
或2.2 ×10-2 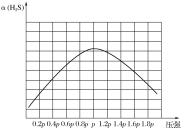
【解析】
(1)根据图示可知,阳极放电的离子应为水电离出的OH-,放电生成氧气,从而导致溶液中H+浓度增大;
(2) 阻碍了光解水的实际应用的因素有光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,能量转化效率低等;
(3)由盖斯定律计算可得;
(4)①依据题给数据和平衡常数公式计算可得;
②纵坐标为转化率,在压强小于p时,未达到平衡,随着压强的增大,反应速率增大,转化率增大;压强达到p后,达到平衡,此时随着压强增大,平衡向左移动,转化率下降。
(1)根据图示可知,阳极放电的离子应为水电离出的OH-,放电生成氧气,从而导致溶液中H+浓度增大,H+与CO32-再反应生成HCO3-,电极反应式为4CO32-+2H2O-4e-=O2↑+4HCO3-,故答案为:4CO32-+2H2O-4e-=O2↑+4HCO3-;
(2)A、可见光区更有普遍性,更有发展前途,故错误;
B、根据题意,研究光腐蚀机理,寻找高稳定性,不产生光腐蚀的制氢材料,故正确;
C、根据题意,研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料,故正确;
D、红外光也是生活中常见光源,研究新的光解水的催化机制,使利用红外光进行光解水制氢成为可能,故正确;
BCD正确,故答案为:BCD;
(3)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的化学方程式应为CH4(g)+2H2O(g)=CO2(g)+4H2(g),根据盖斯定律,该反应的ΔH=2ΔH1-ΔH2=-165 kJ·mol-1,则该反应的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=-165 kJ·mol-1,故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=-165 kJ·mol-1;
(4)①根据图示,T4 ℃达到平衡时,平衡转化率为40%,则平衡时H2S为0.18 mol,H2为0.12 mol,S2为0.06 mol,总物质的量为0.36 mol,因为是恒压容器,刚开始时体积为1 L,则平衡时体积为1.2 L,因此平衡时H2S、H2和S2的浓度分别为0.15 mol·L-1、0.1 mol·L-1和0.05 mol·L-1,则平衡常数K=![]() ≈2.2 ×10-2,故答案为:
≈2.2 ×10-2,故答案为:![]() 或2.2 ×10-2;
或2.2 ×10-2;
②纵坐标为转化率,在压强小于p时,未达到平衡,随着压强的增大,反应速率增大,转化率增大;压强达到p后,达到平衡,此时随着压强增大,平衡向左移动,转化率下降,则不同起始压强下H2S转化率的趋势图为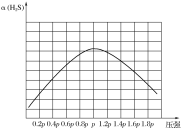 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】现有下列五种有机物:①CH4、②CH2=CH2、③CH3CH2OH、④ CH3 CH2CH2 CH3 、⑤CH3COOH
请回答:
(1)写出⑤的官能团的名称______。
(2)与①互为同系物的是______(填序号)。
(3)写出④ 的同分异构体的结构简式________________。
(4)写出与②发生加成反应生成乙烷的化学方程式_________________________。
(5)③与⑤发生反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学对由NaHCO3和KHCO3组成的某均匀混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
标准状况下,V(CO2) | 2.24L | 3.36L | 3.36L |
(1)盐酸的物质的量浓度为_________。
(2)混合物中,n(NaHCO3):n(KHCO3)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M 均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去)。下列说法中不正确的是( )
![]()
A.若 M 是单质铁,则 Z 溶液可能是 FeCl2 溶液
B.若 M 是氢氧化钠,则 X 水溶液呈酸性
C.若 M 是氧气,则 X、Z 的相对分子质量可能相差 48
D.若 M 是强氧化性的单质,则 X 可能是金属铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]()
![]() ,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,断开![]() 键的数目和生成
键的数目和生成![]() 键的数目相等
键的数目相等
D.容器内气体的浓度![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔盐[硫酸亚铁铵,(NH4)2Fe(SO4)26H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定,易溶于水,难溶于乙醇。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。
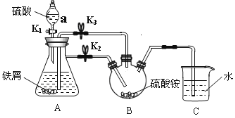
回答下列问题:
Ⅰ.制取莫尔盐
i.连接装置,检査装置气密性。将13.2g(NH4)2SO4晶体置于三颈烧瓶B中,将6.0g洁净铁屑加入锥形瓶中。
ii.打开仪器a瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。
iii.待大部分铁粉溶解后,打开K3、关闭K2,A中浅绿色溶液流入B。
iv.关闭活塞K2、K3,采用100℃水浴蒸发三颈烧瓶中水分,液面产生晶膜时,停止加热,冷却结晶、过滤、洗涤晶体。
(1)仪器a的名称是___。
(2)操作iii中浅绿色溶液会流入B的原因是___。
(3)操作iv中洗涤晶体所用试剂是___(填标号)。
A.水 B.无水乙醇 C.硫酸溶液
Ⅱ.为测定所得莫尔盐晶体纯度,取mg该样品配制成1L溶液,分别设计如下两个实验方案,请回答:
方案一:取20.00mL所配硫酸亚铁铵溶液用0.1000mol·L-1的酸性K2Cr2O7溶液进行滴定。重复三次。(已知:Cr2O72-还原产物为Cr3+)
(4)写出此反应的离子方程式___。
(5)滴定时必须选用的仪器是___。(填标号)
方案二:取20.00mL所配硫酸亚铁铵溶液进行如下实验。
![]()
(6)莫尔盐晶体纯度为___。(用含m、w的式子表示)
(7)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是
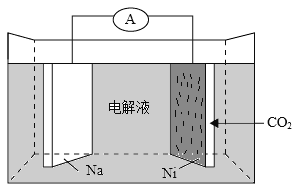
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X的化学式是_____、Y的化学式是_____、Z的名称是_____。
(2)由Y和Z组成,且Y和Z质量比为7:20的化合物的化学式(分子式)是_____。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的一种阳离子是_____。
(4)由X、Y、Z元素按原子个数比为4:2:3组成的化合物,该化合物的化学式(分子式)是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com