
| A. | N2的消耗量是3.0mol | |
| B. | N2的平均速率是0.5mol•(L•min)-1 | |
| C. | N2的平衡浓度是1.0mol•L-1 | |
| D. | N2反应的量占原物质的量的百分数是50% |
分析 平衡时氢气的物质的量为5mol,则反应消耗氢气的物质的量为:8mol-5mol=3mol,根据反应方程式可知平衡时消耗氮气的物质的量为:3mol×$\frac{1}{3}$=1mol;根据v=$\frac{\frac{△n}{V}}{△t}$计算出氮气的平均速率;根据c=$\frac{n}{V}$计算出氮气的平衡浓度;根据$\frac{反应消耗氮气的物质的量}{2mol}$×100%计算出N2反应的量占原物质的量的百分数.
解答 解:A.平衡时氢气的物质的量为5mol,则反应消耗氢气的物质的量为:8mol-5mol=3mol,根据反应方程式可知平衡时消耗氮气的物质的量为:3mol×$\frac{1}{3}$=1mol,故A错误;
B.氮气的平均速率为:$\frac{\frac{1mol}{2L}}{5min}$=0.1mol•(L•min)-1,故B错误;
C.氮气的平衡浓度为:$\frac{2mol-1mol}{2L}$=0.5mol/L,故C错误;
D.N2反应的量占原物质的量的百分数为:$\frac{2mol-1mol}{2mol}$×100%=50%,故D正确;
故选D.
点评 本题考查了化学平衡的计算,题目难度不大,涉及化学反应速率、物质的量浓度、转化率的计算,明确化学反应速率的概念及表达式为解答关键,试题培养了学生的化学计算能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
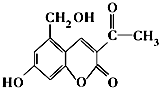
| A. | 亮菌甲素中含有四种官能团 | |
| B. | 亮菌甲素不能与NaHCO3溶液发生反应 | |
| C. | 1 mol亮菌甲素在一定条件下与NaOH溶液完全反应最多能消耗2 mol NaOH | |
| D. | 每个亮菌甲素分子在一定条件下与足量H2反应后的产物有3个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.02mol•L-1•s-1 | B. | 1.5mol•L-1•min-1 | ||
| C. | 0.03mol•L-1•s-1 | D. | 1.8mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②⑦ | C. | ⑤⑥⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
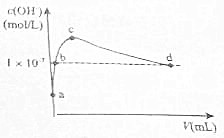 在25℃下,向1L pH=10的KOH溶液中逐滴加酒石酸(酒石酸用H2T表示,其酸性略大于H2CO3).加入的酒石酸体积(y)与溶液中由1m由水电离出的c(0H-)的关系如图所示.下列叙述不正确的是( )
在25℃下,向1L pH=10的KOH溶液中逐滴加酒石酸(酒石酸用H2T表示,其酸性略大于H2CO3).加入的酒石酸体积(y)与溶液中由1m由水电离出的c(0H-)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10m01•L-1 | |
| B. | b点溶液中:c(H+)=1×10-7m01•L-1 | |
| C. | c点溶液中:c(K+)>c(HT-)>c(T2-) | |
| D. | d点溶液中:c(K+)=2c(T2-)+c(HT-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率理论可指导怎样在一定时间内快出产品 | |
| B. | 化学平衡理论可指导怎样使用有限原料多出产品 | |
| C. | 当反应达到限度时,无论外界条件如何变化,反应体系内各物质含量始终不变 | |
| D. | 正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com