
(物质结构与性质)(13分)
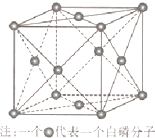
磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。
回答下列问题:
(1)写出基态磷原子的电子排布式
(2)磷化硼的晶体类型是 ,B原子的杂化方式是 。
(3)电负性:N B (填“>”、“<”)
(4)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子。
(5)BBr3分子中,B原子采取sp2杂化,则BBr3属于 (填“极性”或“非极性”)分子
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是 。
科目:高中化学 来源: 题型:阅读理解
 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】
| ||
| 2 |
| ||
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(物质结构与性质)
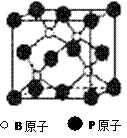 磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。
磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。
回答下列问题:
(1)写出基态磷原子的电子排布式
(2)磷化硼的晶体类型是 ,B原子的杂化方式是 。
(3)电负性:N B (填“>”、“<”)
(4)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子。
(5)BBr3分子中,B原子采取sp2杂化,则BBr3属于 (填“极性”或“非极性”)分子![]()
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com