
在25℃下,将a mol·L-1的CH3COONa与0.02 mol·L-1的盐酸等体积充分混合,反应后测得溶液pH=7,则:
(1)a ▲ 0.02(填“<”、“>”或“=”);
(2)c(CH3COO-)+ c(CH3COOH)= ▲ mol·L-1,c(CH3COOH)= ▲ mol·L-1;
(3)CH3COOH的电离平衡常数Ka= ▲ (用含a的代数式表达)。
(4)反应后溶液中各种离子浓度由大到小顺序是 ▲
科目:高中化学 来源: 题型:
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
2NH3(g) △H=-92.6kJ/moL。实验测得起始、平衡时得有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体 系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5L,则平衡时放出的热量<23.15kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为周期表的一部分,其中的编号代表对应的元素。
 |
请回答下列问题:
(1)表中属于d区元素的是 (填编号)。
(2)写出基态⑨原子的电子排布式 。
(3)元素⑦形成的RO32- 含氧酸根的立体构型是 ,其中心原子的杂化轨道类型是 。
(4)元素①的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.该氢化物分子中,①原子采用sp2杂化
(5)元素⑦(用X表示)的氢化物和元素③(用Y表示)的一种氢化物的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2X | 187 | 202 | 2.6 |
| H2Y2 | 272 | 423 | 以任意比互溶 |
H2X和H2Y2相对分子质量基本相同,造成上述物理性质差异的主要原因
、 。
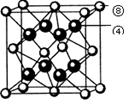 (6)元素④和⑧形成的化合物,其立方晶胞结构如右图所示,则该化合物的化学式是 。若该化合物晶体的密度为a g·cm-3,阿伏加德罗常数为6.02×1023,则晶胞的体积是__________(只要求列出算式)。
(6)元素④和⑧形成的化合物,其立方晶胞结构如右图所示,则该化合物的化学式是 。若该化合物晶体的密度为a g·cm-3,阿伏加德罗常数为6.02×1023,则晶胞的体积是__________(只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应4 NH3(g)+5O2(g)  4NO(g)+6 H2O(g)下列叙述正确的是
4NO(g)+6 H2O(g)下列叙述正确的是
A.达到化学平衡时,4v正(O2)= 5v逆(NO )
B.若单位时间内生成x mol NO,同时消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若缩小容器体积,则正反应速率减少,逆反应速率增大
D.在恒容容器中,若混合气体密度不再改变,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
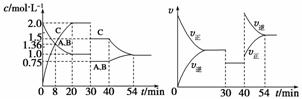
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
下列说法中正确的是
A.30~40 min该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30 min时降低压强,40 min时升高温度
D.8 min时反应第一次达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是



A.蒸馏、蒸发、分液、过滤 B.蒸馏、过滤、分液、蒸发
C.分液、过滤、蒸馏、蒸发 D.过滤、蒸发、分液、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
海带中含碘元素,有人设计如下步骤来提取碘:①加入6%H2O2溶液 ②将海带烧成
灰,向灰中加入蒸馏水 ③加入CCl4振荡 ④过滤 ⑤用分液漏斗分液 ⑥加热煮沸
1~2分钟,合理的操作顺序为
A.②一⑥一④一①一③一⑤ B.②一①一⑥一③一④一⑤
C.②一①一③一⑥一⑤一④ D.②一③一①一⑥一⑤一④
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下
某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下
图所示装置制取NaHCO3,反应的化学方程式为NH3+CO2+H2O+NaCl = NaHCO3↓+NH4Cl。
然后再将NaHCO3制成Na2CO3。Ks5u
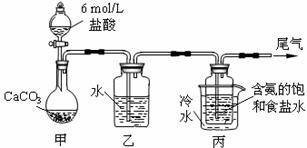 |
⑴ 装置乙的作用是 。为防止污染空
气,尾气中含有的 需要进行吸收处理。
⑵由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有 、
、 。NaHCO3转化为Na2CO3的化学方程式为 。
⑶若在⑵中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min
的NaHCO3 样品的组成进行了以下探究。
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴
加稀盐酸,并不断搅拌。随着盐酸的加
入,溶液中有关离子的物质的量的变化
如右图所示。

则曲线c对应的溶液中的离子是
(填离子符号);该样品中NaHCO3和
Na2CO3的物质的量之比是 。
⑷若取21.0 g NaHCO3固体,加热了t2 min后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol·L-1的盐酸中
则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室要配制1.84 mol·L-1的稀硫酸500mL,回答下列问题:
(1)需要98%密度为1.84 g·cm-3的浓硫酸 mL
(2)配制时,必须使用的仪器有 (填代号)
①烧杯 ②50 mL量筒 ③100 mL量筒 ④1000 mL容量瓶 ⑤500 mL容量瓶 ⑥托盘天平(带砝码) ⑦玻璃棒
还缺少的仪器是 。
(3)配制时,该实验两次用到玻璃棒,其作用分别是 、 。
(4)下列操作的顺序是(用字母表示) 。
A. 冷却 B.量取 C.洗涤两次 D.定容 E.稀释 F.摇匀 G.转移
(5)下列操作中,容量瓶所不具备的功能有 (填序号)。
A. 配制一定体积准确浓度的标准溶液 B. 长期贮存溶液
C. 用来加热溶解固体溶质 D. 作为反应容器
(6)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
① 用量筒量取浓硫酸时,仰视读数
② 转移后,没有洗涤烧杯和玻璃棒
③ 定容时,俯视读数
④ 定容时,添加蒸馏水超过刻度线后,吸出多余的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com